
Cientistas da Universidade de Groningen, Dr. Hein Wijma (à esquerda) e Prof. Dr. Dick B. Janssen, que usou uma nova abordagem computacional para redesenhar a enzima aspartase e convertê-la em um catalisador para reações de hidroaminação assimétricas. Crédito:Universidade de Groningen
Os biotecnologistas da Universidade de Groningen usaram um método computacional para redesenhar a aspartase e convertê-la em um catalisador para reações de hidroaminação assimétricas. Seus colegas na China aumentaram a produção dessa enzima e conseguiram produzir quilos de blocos de construção muito puros para produtos farmacêuticos e outros compostos bioativos. Este estudo de prova de princípio bem-sucedido foi publicado em Nature Chemical Biology em 21 de maio.
As enzimas são catalisadores naturais que funcionam em condições moderadas. Eles são uma alternativa atraente para reações químicas não catalisadas que muitas vezes requerem altas temperaturas ou pressão que consomem energia e podem gerar produtos colaterais tóxicos ou usar solventes. Mas há um problema:a gama de reações catalisadas por enzimas é limitada. "É por isso que muito esforço está sendo feito para modificar as enzimas naturais, "explica Dick Janssen, Professor de Biotecnologia Química no Instituto de Biomolecular e Biotecnologia de Groningen.
O método clássico para modificar enzimas é a evolução direcionada, uma sequência de seleção de mutação no laboratório que visa criar enzimas com habilidades catalíticas modificadas. Mas dá muito trabalho fazer e testar centenas ou milhares de variantes enzimáticas em várias rodadas. Seria muito mais eficiente fazer um projeto racional das mudanças necessárias com base nas informações sobre a estrutura e as propriedades da enzima.
Mas mesmo isso é complicado, explica Hein Wijma. Ele é um especialista em software de design molecular e fez a maior parte do trabalho computacional no estudo. "As proteínas são feitas de 20 aminoácidos diferentes. Então, se você quiser alterar uma enzima em quatro posições, existem 20 opções para cada um deles. Isso resulta em uma enorme matriz de estruturas de proteínas. "Testando-as uma por uma, mesmo no computador, leva muito tempo. Contudo, um algoritmo de pesquisa Monte Carlo muito rápido acelera a descoberta do resultado correto, procurando tendências na reatividade da enzima.
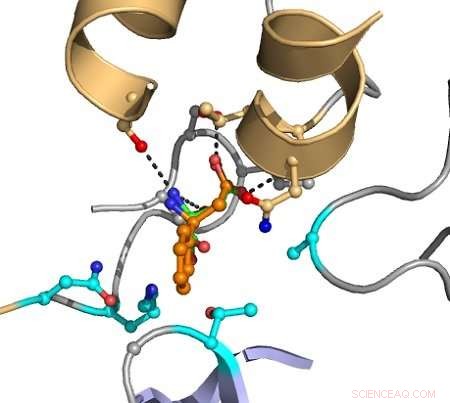
As linhas tracejadas indicam interações entre átomos que causam catálise. O substrato alvo é mostrado em laranja, e os grupos indicados em magenta são variados no computador para descobrir mutantes que melhoram a conversão. Crédito:Hein Wijma / Universidade de Groningen
"No fim, levou alguns dias para realizar esta pesquisa em um cluster de computador dedicado na Universidade de Groningen, "diz Wijma. Mas foi necessária muita modelagem de antemão." Você tem que modelar o centro reativo, os bolsos onde o substrato se liga, e determinar a distância entre os aminoácidos e suas posições e ângulos relativos. "Como o grupo usou uma enzima (aspartase) como ponto de partida para várias reações diferentes, o ponto de partida era sempre o mesmo. Isso significava que eles só tinham que mudar a reação do alvo. Wijma:"Se quiséssemos fazer uma nova modificação da aspartase, isso provavelmente levaria apenas três meses agora. "
O artigo de pesquisa descreve quatro conversões, todas as adições de amônio. Aspartase é uma desaminase, então a reação foi revertida. "A catálise vai para os dois lados, então isso não é um grande problema, "diz Janssen. Para cada conversão, a seleção inicial pelo algoritmo produziu cerca de 100 mutantes promissores. Em seguida, foram verificados os erros óbvios. Janssen:"No final, cerca de cinco a 20 mutantes foram realmente feitos no laboratório e testados para ver se funcionavam conforme o esperado. "
A próxima etapa foi testar enzimas mutantes bem-sucedidas em um ambiente ampliado. "Este trabalho foi feito por um ex-aluno de Ph.D. e pós-doutorado de nosso laboratório, Bian Wu, que agora é professor assistente na China, "diz Janssen." Ele mostrou quais candidatos podiam produzir grandes quantidades do produto necessário. "Conversões de substrato de 99% com enantioseletividade de 99% foram obtidas em quantidades de até um quilograma, o que significa que as enzimas previstas pelos métodos de cálculo parecem adequadas para uso em um ambiente industrial. "Esta é a verdadeira prova do princípio de que nosso método de seleção in-silico de mutantes funciona para a produção de enzimas úteis, "conclui Janssen.