Crédito alvo de proteína:Elena Khavina / MIPT
Pesquisadores do MIPT e de várias universidades americanas e chinesas resolveram a estrutura de uma das proteínas mais importantes do sistema nervoso em complexo com várias moléculas de drogas. A descoberta abre oportunidades para o desenvolvimento de novos medicamentos com ação regulada e menos efeitos colaterais. O artigo foi publicado na revista Célula .
Muitos medicamentos modernos têm como alvo as proteínas, uma vez que são responsáveis pela maioria das reações físicas e químicas em uma célula. As moléculas de proteína também permitem que as células se comuniquem, transmitindo sinais entre elas. Quando uma pessoa adoece, a harmonia nas células é interrompida, assim, as drogas são usadas para recuperar o equilíbrio, aumentando ou reduzindo temporariamente a atividade das proteínas. Muitos deles têm funções semelhantes e têm estruturas quase idênticas, o que significa que um medicamento pode afetar vários tipos de proteínas. Essa capacidade das drogas de interagir com múltiplos alvos proteicos é chamada de polifarmacologia.
Quando a abordagem molecular para o desenvolvimento de drogas foi introduzida pela primeira vez, uma noção geral entre os farmacologistas era que a eficácia do medicamento dependia de como um determinado medicamento interagia com uma determinada proteína. A interação com outros tipos de proteínas, Contudo, foi pensado para causar apenas efeitos colaterais adversos. Então, naquela época, o principal objetivo da farmacologia era maximizar a seletividade, isto é, a capacidade de um medicamento de atingir apenas um tipo específico de proteínas. O conceito recebeu um nome metafórico do vencedor do Prêmio Nobel Paul Ehrlich, que cunhou o termo "balas mágicas" para se referir a tais medicamentos altamente seletivos.
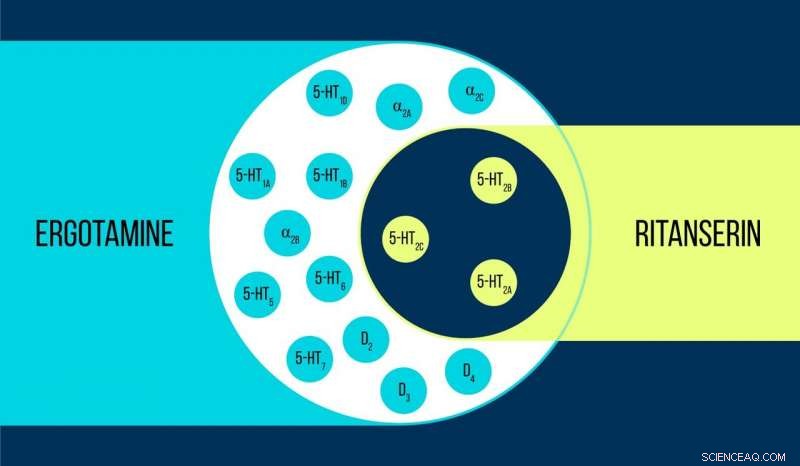
Comparação de ergotamina e ritanserina Crédito:Elena Khavina / MIPT
Contudo, como costuma acontecer, o conceito mais simples não é necessariamente o mais bem-sucedido. Os avanços nas tecnologias de computação em química e biologia tornaram possível a produção de drogas extremamente seletivas que agiam em apenas dois ou três subtipos próximos de uma proteína-alvo. Mas eles não foram tão eficazes quanto seus análogos de baixa seletividade no tratamento de distúrbios complexos como a depressão:os perfis polifarmacológicos de alguns medicamentos provaram ser importantes para seus efeitos benéficos. Descobriu-se que a polifarmacologia não causa necessariamente efeitos colaterais adversos, no entanto, é importante controlar quais proteínas são afetadas. A noção de uma "bala mágica" foi substituída pelo conceito de "espingarda mágica", que enfatiza drogas com um efeito desejado em uma combinação particular de alvos.
O objetivo desta pesquisa foi identificar as características estruturais das proteínas que explicariam por que algumas drogas agem sobre elas seletivamente e outras não. Para realizar o estudo, os cientistas usaram o receptor de serotonina 5-HT2c - uma proteína sinalizadora localizada na membrana celular, que é ativado pela serotonina para receber sinais de células vizinhas. O receptor possui várias características importantes. Primeiro, já é usado como um alvo validado para medicamentos anti-obesidade, além de ser um alvo terapêutico potencial para vários transtornos mentais. Segundo, é direcionado por uma série de medicamentos com uma ampla gama de seletividades, tornando possível compará-los. Em terceiro lugar, um corpo humano tem mais de 800 outros receptores que são semelhantes em estrutura ao 5-HT2c, mas têm funções diferentes. É por isso que seus antagonistas não seletivos costumam ter uma infinidade de efeitos colaterais.
Vsevolod Katritch, um professor visitante no MIPT, diz, "Usamos dois produtos químicos para trabalhar com o receptor de serotonina 5-HT2c:ergotamina e ritanserina. A ergotamina é um agonista não seletivo com um amplo perfil polifarmacológico:influencia a serotonina, dopamina, e receptores adrenérgicos. Ritanserin, por contraste, tem um perfil mais estreito [figura 1] e é o agonista inverso seletivo do receptor 5-HT2c. Assim, as estruturas atômicas 5-HT2c obtidas no complexo com ergotamina e ritanserina ajudam não apenas a explicar as diferenças entre os estados do receptor ativo e inativo - o que é em si uma conquista considerável - mas também a descobrir as razões para tal seletividade molecular. "
Crédito:Instituto de Física e Tecnologia de Moscou
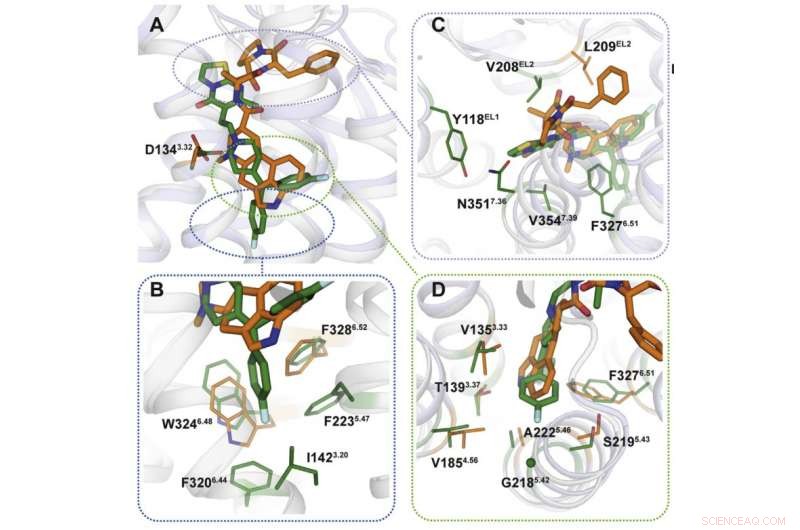
Usando cristalografia de raios-X, os cientistas obtiveram um modelo 3-D de proteínas no momento de sua interação com as drogas. Previsivelmente, os mecanismos de ligação dos medicamentos eram diferentes (figura 2). Os locais de ligação direcionados pela ergotamina são semelhantes em muitas proteínas, o que explica a não seletividade do produto químico. Ritanserin, por outro lado, interage com o receptor de forma diferente e age apenas em alguns de seus fragmentos que são exclusivos de um pequeno grupo de proteínas. Apresentando várias mutações que alteram esses fragmentos no gene do receptor 5HT2c, os pesquisadores notaram que a interação com a ritanserina se tornou menos eficaz - o que confirmou que essas áreas de proteínas são as responsáveis pela seletividade do produto químico.
Petr Popov, um pesquisador do Laboratório de Biologia Estrutural de Receptores Acoplados à Proteína G do MIPT, diz, "O principal desafio na identificação de estruturas de receptor foi a obtenção de um construção geneticamente modificada que seria adequada para cristalização e com a qual poderíamos trabalhar e estudar. Usando a abordagem bioinformática e métodos de aprendizado de máquina, identificamos mutações de ponto de estabilização para o receptor 5HT2c em seus estados ativo e inativo. "
Assim, a análise das características estruturais de proteínas em complexo com fármacos de seletividade variada mostrou-se eficaz. Ele pode ser usado para controlar o conjunto de alvos e, portanto, os efeitos diretos e colaterais de um medicamento durante seu desenvolvimento. Também, esses medicamentos irão beneficiar muitos pacientes graças aos perfis terapêuticos aprimorados que combatem uma variedade de doenças e têm menos efeitos colaterais.