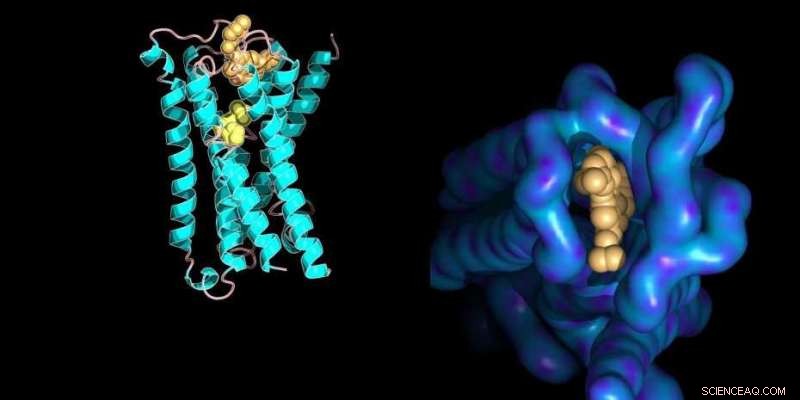
Modelo molecular de um receptor de membrana de proteína ligado a seus ligantes de pequenas moléculas com detalhes estruturais do sítio de ligação alostérico (direita). Crédito:Ilaria Piazza / ETH Zurique / entrada de banco de dados PDB 4MQT
Os pesquisadores da ETH Zurich usaram uma nova abordagem para descobrir interações até então desconhecidas entre proteínas e pequenas moléculas metabólicas em células bacterianas. A técnica também pode ser usada para testar o efeito de medicamentos.
A ciência agora tem uma nova "ômica" - uma interatividade, que lida com as interações entre proteínas e pequenas moléculas. Tendo anteriormente focado em genômica ou proteômica, os biólogos do sistema agora podem adicionar interômica proteína-metabólito à mistura. A genômica se preocupa com a análise sistemática de todos os genes de um organismo, enquanto a proteômica lida com todo o conjunto de proteínas dentro de uma unidade biológica.
Com a interactômica proteína-metabólito, o grupo liderado por Paola Picotti, Professor de Biologia de Sistemas Moleculares na ETH Zurique, agora adicionou outro nível às "ômicas" existentes. Os pesquisadores publicaram recentemente um estudo na revista Cell, em que eles analisaram e quantificaram sistematicamente as interações de todas as proteínas com metabólitos (pequenas moléculas metabólicas) no nível de todo o proteoma pela primeira vez, estabelecer as relações entre eles.
Diferentes locais de corte
Os pesquisadores demonstraram quantas proteínas e enzimas presentes em uma célula bacteriana de E. coli interagem com metabólitos. Para fazer isso, eles usaram uma abordagem conhecida como proteólise limitada (LiP), combinado com análise espectrométrica de massa.
Os pesquisadores extraíram fluido celular, que contém proteínas, das células bacterianas. Eles então adicionaram um metabólito a cada amostra e permitiram que ela interagisse com as proteínas. Finalmente, eles cortam as proteínas em pedaços menores (peptídeos) usando "tesouras moleculares". No total, os pesquisadores testaram 20 metabólitos diferentes e suas interações com proteínas dessa forma.
Quando uma proteína interage com um metabólito, se ele se instala no local ativo da proteína ou se liga a outro local, a estrutura da proteína é alterada. A "tesoura molecular" então o corta em locais diferentes da estrutura original, resultando em um conjunto diferente de peptídeos.
Usando o espectrômetro de massa, os pesquisadores mediram todas as peças presentes na amostra e alimentaram os dados obtidos em um computador para reconstruir as diferenças e mudanças estruturais, e onde estão localizados na proteína.
Centenas de novas interações descobertas
Conhecimento sobre o interactoma proteína-metabólito (as interações entre proteínas e metabólitos e as redes moleculares (sinal) pertencentes a eles), era anteriormente muito limitado em comparação com o que se sabia sobre as interações entre diferentes proteínas ou entre proteínas e DNA ou RNA. O estudo agora aumentou drasticamente esse conhecimento.
Usando essa abordagem com E. coli, Picotti e sua equipe descobriram cerca de 1, 650 diferentes interações proteína-metabólito, dos quais mais de 1, 400 eram desconhecidos. Milhares de locais de ligação em proteínas às quais os metabólitos podem se ligar também vieram à tona. "Embora o metabolismo de E. coli e moléculas associadas já seja muito conhecido, conseguimos descobrir muitas novas interações e os locais de ligação correspondentes, "diz Picotti. Isso comprova o enorme potencial do método:" Os dados que produzimos com esta técnica vão ajudar a identificar novos mecanismos regulatórios, enzimas desconhecidas e novas reações metabólicas na célula. "
Mudança estrutural regula a atividade
Em seu estudo, os pesquisadores também mostram que pequenas moléculas metabólicas preferem se ligar a (e assim regular) proteínas cuja concentração é mais ou menos constante ao longo do tempo. Isso sugere que a ligação de metabólitos a proteínas e mudanças nas concentrações de proteínas são duas vias complementares pelas quais as células regulam a atividade das proteínas.
As proteínas podem ser ativadas ou inativadas de forma relativamente rápida por uma mudança estrutural mediada por metabólitos. "Esse tipo de mudança estrutural pode ser revertido mais rapidamente, "explica Picotti. Do ponto de vista da célula, isso geralmente faz sentido, porque usar a via que envolve uma mudança na concentração significa que a célula deve desmontar ou reconstruir as proteínas, o que custa mais tempo, energia e recursos.
Picotti e seus colegas também conseguiram mostrar que muitas enzimas são menos exigentes do que se pensava anteriormente:elas podem aparentemente se ligar e alterar quimicamente vários metabólitos diferentes. Até agora, presumia-se que as enzimas eram principalmente específicas para algumas moléculas muito semelhantes.
A indústria farmacêutica está muito interessada na nova abordagem, pois pode ser usado para testar a interação de drogas com proteínas celulares e identificar os alvos de uma droga. Os pesquisadores poderiam investigar quais proteínas e os locais aos quais esta droga se liga, como ele altera sua estrutura e, portanto, influencia sua atividade. Isso facilitaria e aceleraria os testes e o desenvolvimento de novos medicamentos.