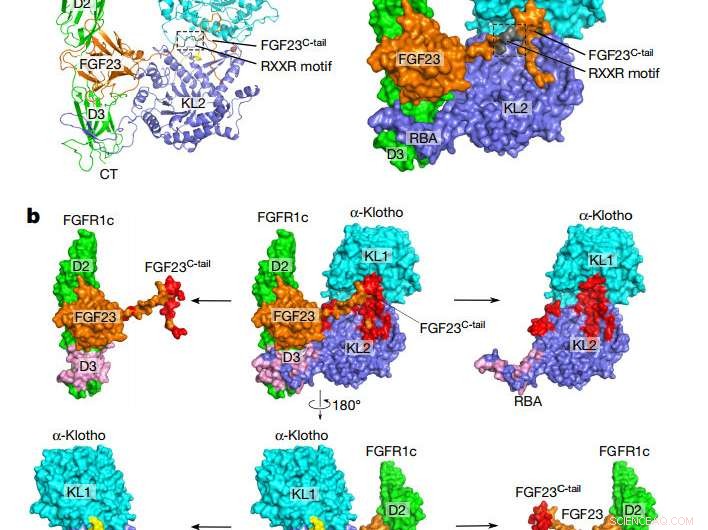
Topologia geral do complexo FGF23 – FGFR1cecto – α-klothoecto. uma, Desenho animado (à esquerda) e representação superficial (à direita) da estrutura do complexo ternário. Os domínios α-klotho KL1 (ciano) e KL2 (azul) são unidos por um ligante curto rico em prolina (amarelo; não visível na apresentação da superfície). O FGF23 está em laranja com seu motivo de clivagem proteolítica em cinza. O FGFR1c está em verde. CT, Terminal C; NT, Terminal N. b, Interfaces de ligação entre α-klothoecto e o complexo FGF23 – FGFR1cecto. O complexo ternário (centro) é mostrado em duas orientações diferentes relacionadas por uma rotação de 180 ° ao longo do eixo vertical. As interfaces FGF23 – α-klothoecto (vermelho) e FGFR1cecto– α-klothoecto (rosa) são visualizadas puxando α-klothoecto e o complexo FGF23 – FGFR1cecto para longe um do outro. Os componentes separados são mostrados à esquerda e à direita do complexo ternário. Crédito: Natureza (2018). DOI:10.1038 / nature25010
Um novo estudo revela a estrutura molecular de uma proteína chamada alfa (α) Klotho, e como isso ajuda a transmitir um sinal hormonal que retarda o envelhecimento.
Liderado por pesquisadores da NYU School of Medicine e publicado online em 17 de janeiro em Natureza , o estudo refuta a conjectura de 20 anos de que o αKlotho - batizado em homenagem à deusa grega que tece o fio da vida - é um importante hormônio anti-envelhecimento. Em vez disso, os resultados atribuem esta função ao fator de crescimento de fibroblastos 23 (FGF23), e explicar como αKlotho simplesmente ajuda o FGF23 a mediar sua ação anti-envelhecimento.
Estudos já em 1997 mostraram que camundongos geneticamente manipulados para não ter αKlotho ou FGF23 sofriam de envelhecimento prematuro, incluindo doença cardiovascular de início precoce, Câncer, e declínio cognitivo. Ao fornecer uma primeira olhada na estrutura do grupo associado de proteínas que inclui FGF23, sua proteína receptora (FGFR), e αKlotho, o estudo atual derruba o dogma de que o αKlotho atua por conta própria como um fator de longevidade.
"Ao mostrar que todas as maneiras pelas quais o αKlotho deveria proteger os órgãos vêm de sua capacidade de ajudar a sinalizar o FGF23, lançamos uma nova luz sobre a causa subjacente do envelhecimento, "diz o autor do estudo, Moosa Mohammadi, PhD, professor do Departamento de Bioquímica e Farmacologia Molecular da NYU Langone Health. "Nossos novos dados estruturais também abrem caminho para o projeto de novos agentes que podem encorajar ou bloquear a sinalização de FGF23-αKlotho conforme necessário."
Estrutura Resolve Mistério
Para determinar a estrutura atômica do grupo de proteínas de sinalização FGF23, Mohammadi e seus colegas usaram cristalografia de raios-X. A equipe primeiro persuadiu o hormônio FGF23, junto com sua proteína receptora (FGFR) e αKlotho, para resolver uma solução e formar pilhas de repetição, cristais ordenados. Eles então expuseram os cristais a raios-X, e usou os padrões refletidos para calcular a estrutura atômica das proteínas.
O novo estudo fornece a primeira evidência de como o FGF23 só pode sinalizar para as células, formando um complexo com αKlotho, seu receptor, e outro parceiro em sulfato de heparano. Feito por células ósseas, o hormônio FGF23 é conhecido por viajar através da corrente sanguínea para células em outros órgãos, onde ele transmite sua mensagem ao se encaixar em seu receptor e ligá-lo. A estrutura complexa recém-resolvida revela como αKlotho amarra o FGF23 ao seu receptor com tenacidade suficiente para ativá-lo.
O estudo também lança uma nova luz sobre como a doença renal leva a um espessamento anormal do tecido do músculo cardíaco denominado hipertrofia. A hipertrofia cardíaca é a principal causa de morte em pessoas com túbulos renais danificados, causada (por exemplo) por hipertensão e diabetes. Quando os túbulos renais danificados não conseguem mais eliminar adequadamente o fosfato na urina, O FGF23 aumenta em um esforço para manter o fosfato do sangue sob controle, em parte, controlando os níveis de vitamina D. Uma hipótese predominante é que níveis muito elevados de FGF23 causam hipertrofia no coração, mas a teoria permaneceu controversa porque o tecido do coração não tem αKlotho, que deve estar presente para que o FGF23 sinalize.
Estudos anteriores mostraram que a forma mais conhecida de αKlotho é imóvel, sendo ligado às membranas superficiais das células nos túbulos renais, a glândula paratireóide, e certas regiões do cérebro. Em seguida, os pesquisadores descobriram que uma parte da proteína αKlotho que se projeta da superfície das células, o domínio ecto, pode ser cortado e derramado em fluidos corporais circulantes, e, portanto, pode atingir o coração. Evidências iniciais, Contudo, sugeriu que o αKlotho derramado era incapaz de atuar como um co-receptor do FGF23. O novo estudo integra essas observações, mostrando que o αKlotho circulante pode de fato funcionar exatamente como sua forma ligada à membrana para permitir a sinalização de FGF23.
Os pesquisadores afirmam que suas descobertas lançarão outra corrida de desenvolvimento de medicamentos para doenças renais. Mohammadi já havia mostrado que uma peça-chave do hormônio FGF23 (seu peptídeo C-terminal da cauda), quando injetado em camundongos, compete com o FGF23 intacto para reduzir seu sinal e prevenir a hipertrofia do coração. Além disso, a equipe já está projetando novas moléculas que alteram o sinal FGF23 / shed αKlotho com base nas estruturas de proteína recém-descobertas.
O estudo também sugere que uma proteína relacionada, beta-Klotho, serve como o mesmo tipo de co-receptor para ajudar o FGF21, um hormônio relacionado ao FGF23. O FGF21 funciona enviando sinais que mantêm o açúcar no sangue e os ácidos graxos em equilíbrio, com implicações para diabetes e obesidade.