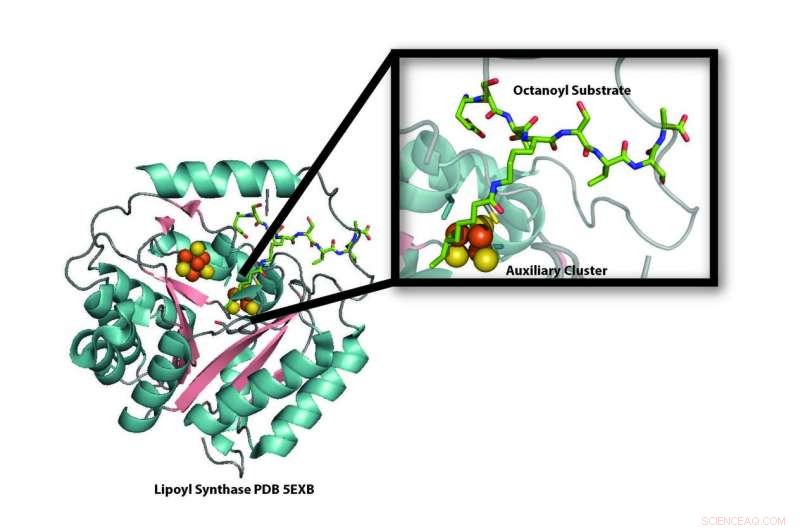
Modelo da estrutura cristalina da enzima lipoil sintase (LipA) da bactéria Mycobacterium tuberculosis revelando a destruição de um de seus aglomerados ferro-enxofre (bolas laranja e amarelas) para uso como fonte de enxofre na produção de ácido lipóico. Uma nova pesquisa demonstra que o cluster ferro-enxofre que é destruído durante a produção de ácido lipóico é substituído por uma proteína transportadora ferro-enxofre, NfuA, para que a LipA possa continuar a produzir ácido lipóico. Crédito:Laboratório Booker, Penn State University
Uma nova pesquisa mostra como uma proteína é consumida e depois reconstituída durante a produção de ácido lipóico, um composto exigido por nossos corpos para converter a energia dos alimentos em uma forma que pode ser usada por nossas células. A enzima lipoil sintase (LipA) remove dois átomos de hidrogênio de uma cadeia de carbono inerte e os substitui por átomos de enxofre de um de seus próprios aglomerados de ferro-enxofre para criar ácido lipóico, tornando-se inativo no processo. A nova pesquisa da Penn State University, que será publicado na revista Ciência em 20 de outubro, 2017, mostra que outra proteína, um transportador de aglomerado de ferro-enxofre denominado NfuA, substitui o aglomerado de ferro-enxofre destruído em LipA, permitindo que continue produzindo ácido lipóico. Os resultados também podem ajudar os cientistas a entender por que humanos com defeitos no gene carreador ferro-enxofre - uma condição fatal - têm deficiências de ácido lipóico.
"A LipA se canibaliza para fornecer os átomos de enxofre necessários para a produção de ácido lipóico, "disse o escudeiro Booker, professor de química e de bioquímica e biologia molecular na Penn State University, um investigador do Howard Hughes Medical Institute, e o autor correspondente do artigo de pesquisa. “Quando demonstramos isso em 2011, era desconcertante porque se LipA fosse destruída, como a célula poderia produzir ácido lipóico suficiente? "
LipA é um membro da família de enzimas do radical SAM (S-adenosilmetionina). Como a maioria das enzimas SAM radicais, contém um aglomerado de quatro átomos de ferro e quatro átomos de enxofre, que ele usa para converter SAM em um radical de alta energia. Por sua vez, esse radical pode remover átomos de hidrogênio de outras moléculas, uma etapa necessária para ativar muitas reações metabólicas celulares importantes. Os átomos de hidrogênio são substituídos por enxofre para completar o processo.
De onde vêm os átomos de enxofre que a LipA usa para produzir ácido lipóico e como eles se ligam têm sido as principais questões na área. Como outras enzimas anexam átomos de oxigênio aos centros de carbono inertes é bastante bem compreendido. Nesses casos, oxigênio, que está onipresente na atmosfera, é usado para criar radicais de alta energia e também é a fonte do átomo de oxigênio anexado. Enxofre, por outro lado, não está disponível de forma semelhante, mas ao contrário da maioria das outras enzimas SAM radicais, LipA tem um cluster adicional de ferro-enxofre.
"Sabíamos de trabalhos anteriores que LipA usava seu segundo cluster ferro-enxofre como fonte de átomos de enxofre para criar ácido lipóico, "disse Erin L. McCarthy, um estudante de graduação no laboratório de Booker e o primeiro autor do artigo. "Mas isso criou um problema. Se LipA roubou átomos de enxofre de seu próprio aglomerado ferro-enxofre, a enzima seria destruída e, portanto, não poderia criar mais ácido lipóico. Quando aprendemos que os humanos com genes NFU1 defeituosos, o equivalente humano do gene NfuA bacteriano usado em nossos experimentos, tinha deficiências de ácido lipóico, pensamos que este carreador ferro-enxofre poderia estar substituindo o cluster ferro-enxofre consumido na LipA, permitindo que continue produzindo ácido lipóico. "
Para testar esta hipótese, os pesquisadores realizaram dois experimentos importantes. Primeiro, eles testaram se LipA e NfuA se associam, avaliando a rapidez com que as moléculas migram através de um gel por uma técnica chamada cromatografia de filtração em gel. Nesta técnica, moléculas grandes migram mais rápido do que moléculas menores. Quando LipA e NfuA foram combinados e, em seguida, analisados por esta técnica, eles migraram mais rápido do que qualquer molécula sozinha, sugerindo que as duas moléculas foram ligadas para formar uma maior, molécula de migração mais rápida. Os pesquisadores então criaram uma versão do NfuA que continha uma forma ligeiramente diferente de átomos de enxofre (34S em vez de 32S), uma forma que eles poderiam rastrear se fosse incorporada à LipA e depois ao ácido lipóico. Neste segundo experimento, os pesquisadores mostraram que depois que o 32S originalmente presente na LipA foi consumido na reação química para produzir ácido lipóico, o ácido lipóico foi produzido contendo 34S, que só poderia ter vindo de seu NfuA projetado.
"Já faz algum tempo que estamos interessados no processo que adiciona enxofre a um composto de carbono inerte para fazer ácido lipóico e na fonte do enxofre adicionado, "disse Booker." O ácido lipóico é um componente vital dos processos metabólicos básicos que mantêm nossas células vivas. Compreender a reação que o cria não só nos permite compreender melhor este processo, também nos dá uma visão sobre doenças humanas como a causada por mutações em NFU1 que resultam em deficiência de ácido lipóico e morte. "