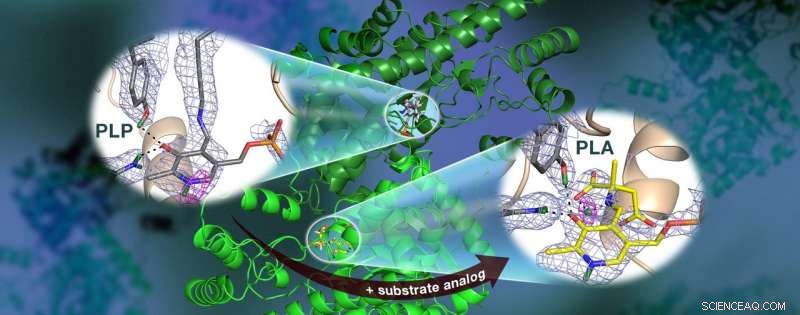
Uma equipe liderada por ORNL usou nêutrons para observar a enzima AAT, uma proteína dependente de vitamina B6, e descobriram que a reação química ocorreu apenas em um sítio ativo. Mapas de densidade de comprimento de espalhamento nuclear (malha colorida) destacam as posições de átomos de hidrogênio críticos, incluindo uma ligação de hidrogênio de baixa barreira (malha magenta) que não existe no AAT, o que pode ser crucial para a catálise. Crédito:Jill Hemman e Andrey Kovalevsky / Laboratório Nacional de Oak Ridge, Departamento de Energia dos EUA
Cientistas do Laboratório Nacional Oak Ridge do Departamento de Energia realizaram análises estruturais de nêutrons de uma proteína dependente de vitamina B6, potencialmente abrindo caminhos para novos antibióticos e medicamentos para combater doenças como a tuberculose resistente a medicamentos, malária e diabetes.
Especificamente, a equipe usou a cristalografia de nêutrons para estudar a localização dos átomos de hidrogênio na aspartato aminotransferase, ou AAT, uma enzima vital para o metabolismo de certos aminoácidos.
"Visualizamos a primeira estrutura de nêutrons de uma enzima da vitamina B6 que pertence a uma grande família de proteínas com centenas de membros que existem na natureza, "disse Andrey Kovalevsky do ORNL, um co-autor sênior do estudo, que foi publicado na Nature Communications.
As proteínas dependentes da vitamina B6 fazem parte de um grupo diverso de enzimas que conduzem mais de uma centena de reações químicas diferentes nas células. As enzimas são de interesse biomédico, bem como bioenergia, pesquisadores por causa de seu papel no metabolismo de aminoácidos e outros nutrientes celulares.
"Essas enzimas são únicas, pois cada uma realiza uma reação química específica com extrema precisão, enquanto suprime outras transformações químicas viáveis, "Kovalevsky disse." Como eles conseguem isso não é bem compreendido, mas é de grande importância para o design de medicamentos. "
A pesquisa anterior da equipe previu que os átomos de hidrogênio se movem dentro e ao redor do local ativo da enzima, onde a reação química ocorre, indicando que o posicionamento dos átomos de hidrogênio controla o tipo de reação. Saber a localização precisa dos átomos de hidrogênio pode explicar por que o comportamento dessas enzimas é tão específico, mas o hidrogênio é difícil de detectar com métodos padrão, como a cristalografia de raios-X.
Para determinar diretamente as posições dos átomos de hidrogênio dentro do AAT, a equipe liderada por ORNL voltou-se para técnicas de difração de nêutrons. Os pesquisadores expuseram delicados cristais de proteína a nêutrons usando a linha de luz IMAGINE no High Flux Isotope Reactor e a linha de luz LADI-III no Institut Laue-Langevin em Grenoble, França.
Surpreendentemente, a equipe observou uma reação dentro de uma biomolécula de proteína AAT enquanto outra biomolécula de AAT permaneceu inalterada, fornecer uma perspectiva antes e depois da reação química catalisada por enzima.

Steven Dajnowicz do ORNL (à esquerda) e Andrey Kovalevsky prepararam uma amostra para começar a análise estrutural de nêutrons de uma proteína dependente de vitamina B6 usando a linha de luz IMAGINE no High Flux Isotope Reactor do ORNL. Os resultados do estudo podem abrir caminhos para novos antibióticos e medicamentos para combater doenças. Crédito:Genevieve Martin / Oak Ridge National Laboratory, Departamento de Energia dos EUA
"Os dados revelaram que em uma das estruturas biomoleculares da enzima as ligações covalentes se reorganizaram após uma reação química ocorrida no sítio ativo e, noutro, a reação não tinha acontecido, "Kovalevsky disse." Essencialmente, fomos capazes de obter duas estruturas em um cristal, o que nunca foi feito antes para qualquer proteína que usa nêutrons. "
Com este conhecimento, a equipe fará simulações moleculares para determinar o comportamento específico dos átomos de hidrogênio ao interagir com a enzima. Os resultados podem ser úteis para orientar o projeto futuro de novos medicamentos contra a tuberculose multirresistente, malária, diabetes e bactérias resistentes a antibióticos.
"Este estudo destaca como os nêutrons são uma sonda incomparável para identificar a localização dos átomos de hidrogênio em sistemas biológicos, fornecendo-nos um nível sem precedentes de detalhes estruturais para esta importante enzima, "Disse o cientista da linha de luz LADI-III, Matthew Blakeley.