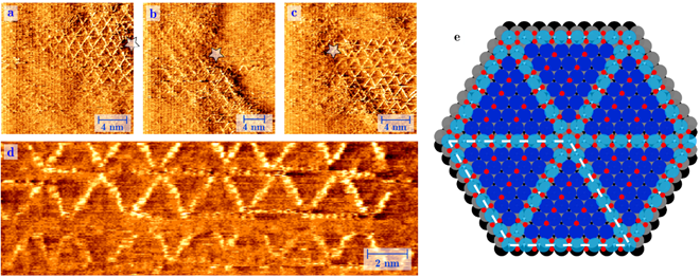
Esquerda:Imagem feita com Microscópio de Varredura de Tunelamento (STM). Imagem de uma superfície de platina sob pressão de 1 atmosfera de oxigênio a 256 ° C. Sob essas circunstâncias, vemos o crescimento espontâneo de uma estrutura de roda de raios de filas de PtO2 embutidas com muitos erros estruturais. À direita:os átomos de platina oxidados em azul claro, os átomos de oxigênio em vermelho e os átomos regulares de platina na superfície em azul escuro (camada 1), cinza (camada 2) e preto (camada 3). Crédito:Universidade de Leiden
Os carros são equipados com catalisadores para desarmar gases tóxicos de exaustão. A platina desempenha um papel importante aí. Os físicos e químicos de Leiden viram pela primeira vez o mecanismo por trás de um catalisador de platina. Com uma compreensão fundamental do processo, os cientistas podem usar este material raro com mais eficiência. Publicação em Nature Communications .
Os gases de escape de mais de um bilhão de carros em todo o mundo contribuem significativamente para o aquecimento global. Mas sem catalisadores, os carros seriam ainda mais poluentes. Depois que os gases de escape tóxicos saem do motor, os catalisadores os convertem em substâncias menos nocivas. Platinum desempenha um papel importante aqui, eliminando o monóxido de carbono tóxico. Este metal nobre é muito raro e, portanto, os cientistas estão pesquisando como usá-lo da forma mais eficiente possível.
Platina
A platina funciona como um catalisador, coletando átomos de oxigênio (O), e deixá-los se ligar ao monóxido de carbono tóxico (CO), para criar o dióxido de carbono menos prejudicial (CO2). O físico Joost Frenken e os químicos Irene Groot e Matthijs van Spronsen, da Universidade de Leiden, pela primeira vez, imaginaram como esse processo funciona no nível atômico. Com um microscópio especial feito em casa, eles viram uma camada ultrafina de oxigênio crescer em uma superfície de platina. Isso aconteceu em circunstâncias realistas, ou seja, à mesma alta pressão e temperatura dentro de um motor, o que tornou o experimento ainda mais difícil. Os pesquisadores descobriram que os átomos de oxigênio estão um tanto "soltos, "para que possam reagir facilmente com outras substâncias. Isso fornece, pela primeira vez, uma boa explicação para a alta atividade catalítica da platina nas reações de oxidação.
Eficiência
Ao desvendar o mecanismo por trás do catalisador de platina, os cientistas de Leiden contribuem para uma melhor compreensão dos fundamentos da catálise. A longo prazo, os cientistas poderiam explorar esse conhecimento para usar materiais raros como a platina com mais eficiência. Groot:"Então, precisamos de menos platina para obter o mesmo resultado, ou entendemos o mecanismo de catálise por trás da platina tão bem que podemos criar um material substituto. "