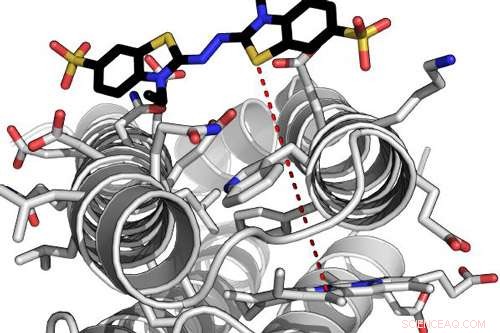
Modelo computacional de uma enzima de novo altamente eficiente interagindo com um de seus substratos. A linha tracejada vermelha indica a distância de tunelamento de elétrons entre a molécula heme ligada à proteína e o substrato ligado. Crédito:Ross Anderson, Universidade de Bristol
Cientistas da Universidade de Bristol desenvolveram uma enzima artificial que funciona tão bem como (e em alguns casos melhor do que) uma classe vital de enzimas naturais.
As enzimas são moléculas biológicas fundamentalmente importantes que realizam a maior parte das reações químicas em todos os organismos vivos.
Essas reações potencializam a vida celular e estão envolvidas em um grande número de processos necessários para dar às células suas características químicas e físicas.
Além disso, muitas enzimas participam de reações químicas que têm valor comercial ou médico, e para as quais não temos boas substâncias artificiais que possam catalisar tais reações com a mesma precisão e eficiência que as enzimas.
A enzima artificial foi sintetizada em uma forma totalmente funcional pela bactéria E. coli e pode ser de interesse significativo para a indústria de biotecnologia devido às suas atividades catalíticas industrialmente relevantes. estabilidade térmica e resistência química.
Eles podem até ser usados como substitutos para certas enzimas naturais que são mais complexas e difíceis de produzir em uma escala maior.
Para conseguir isso, a equipe usou uma abordagem que elimina a complexidade evolutiva, empregando pequenos, proteínas simples e completamente artificiais no processo de design.
Dr. Ross Anderson, da Escola de Bioquímica da Universidade de Bristol, disse:"Nós descrevemos essas proteínas como maquetes, um termo usado em escultura para denotar um modelo em escala a partir do qual uma obra final é criada.
"A maquete de proteína permite que o designer incorpore elementos funcionais em uma estrutura de proteína estável. Neste caso, adaptamos um projeto de maquete anterior em que usamos a maquinaria presente em uma célula bacteriana viva para enxertar permanentemente a molécula heme na estrutura da proteína. "
As alterações feitas, facilitou a ligação do peróxido de hidrogênio à molécula heme, uma etapa necessária na catálise comum à família de enzimas peroxidase.
Com essas mudanças, a maquete era capaz não só de se ligar ao peróxido de hidrogênio, mas também de convertê-lo em uma forma mais reativa que pode puxar elétrons de uma gama de moléculas orgânicas simples, da mesma forma que as peroxidases naturais funcionam.
Como a maquete também é totalmente montada em células bacterianas, proporcionou à equipe a oportunidade de explorar essas transformações químicas em células vivas, ou considerar integrá-lo nas vias metabólicas de um organismo.
O Dr. Anderson acrescentou:"Então, em essência, criamos uma enzima artificial (ou de novo) que funciona tão bem como (e em alguns casos melhor do que) uma classe vital de enzimas naturais.
“É promíscuo - como muitas das peroxidases naturais - e pode ser um protótipo robusto a partir do qual muitos catalisadores funcionais podem ser desenvolvidos.
"Na atividade catalítica, é tão próximo das enzimas naturais (e dado o fato de que as bactérias o produzem em uma forma ativa), se fosse purificada sem o conhecimento de suas origens artificiais, seria atribuída uma função natural e tratada como uma nova enzima natural. "