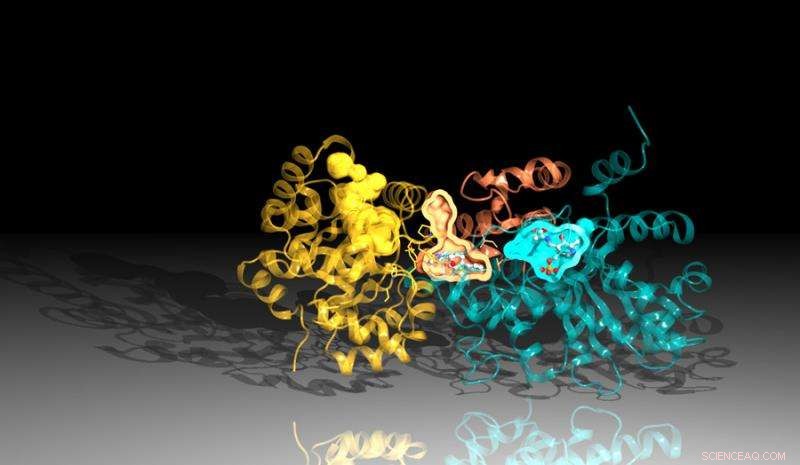
Imagem da proteína triptofano sintase criada usando dados de difração da Fonte Avançada de Fótons de Argonne. O inibidor se liga entre os locais de reação na proteína, representado aqui pelos bolsos laranja e azul. Crédito:Laboratório Nacional de Argonne
A tuberculose já ultrapassou o HIV em todo o mundo como a principal causa de morte por doenças infecciosas. A bactéria que causa esta doença, Mycobacterium tuberculosis (Mtb), está desenvolvendo rapidamente resistência aos antibióticos disponíveis atualmente, aumentando a urgência de descoberta de novos medicamentos.
Cientistas do Laboratório Nacional de Argonne do Departamento de Energia dos Estados Unidos (DOE) fizeram parte de uma recente descoberta de uma nova molécula chamada inibidor que ataca bactérias causadoras da tuberculose interrompendo a produção de um produto químico necessário para sua sobrevivência.
A criação de antibióticos envolve o desenvolvimento de inibidores que podem bloquear com eficácia os processos bacterianos essenciais. Tão importante é continuar encontrando novos caminhos para atingir o alvo, para que, quando a bactéria eventualmente se adapte para resistir a um antibiótico, ainda existem outros caminhos disponíveis para explorar.
O novo estudo, uma colaboração entre Argonne, a Universidade de Chicago e o Broad Institute of Harvard e MIT, identificou um inibidor que atua bloqueando a ação de uma proteína importante no Mtb. O inibidor se liga a um canal dentro da proteína que conecta suas duas partes, matando as bactérias por meio de uma reviravolta irônica. O inibidor força uma parte da proteína a produzir os componentes necessários para criar um produto químico essencial, triptofano, enquanto, ao mesmo tempo, remodela o canal para interceptar esses ingredientes antes que a outra parte da proteína possa usá-los.
Esses tipos de inibidores, chamados de inibidores alostéricos, não se ligue à parte da proteína realmente responsável pela produção do produto químico-alvo. Em vez de, eles agem como uma chave inglesa presa em outras partes menos óbvias do complicado mecanismo da bactéria. O inibidor identificado nesta pesquisa, descrito em um artigo recente na Nature Chemical Biology, é agora um dos inibidores alostéricos mais estudados até hoje.
O produto químico alvo, triptofano, é uma substância crucial para dar estrutura a todas as células vivas e protegê-las do ambiente. As células humanas têm que vasculhar o triptofano dos alimentos ou bactérias no intestino, mas as células Mtb podem fabricar seu próprio triptofano usando uma proteína complexa chamada triptofano sintase. "Sabíamos que uma forma de matar essas bactérias era encontrar uma maneira de bloquear a triptofano sintase, "disse Karolina Michalska, um cristalógrafo de Argonne e autor do estudo.
Antes do início da colaboração, um grupo de cientistas do Broad Institute colocou uma pequena quantidade da bactéria em placas de Petri e colocou diferentes inibidores potenciais em cada uma. De uma biblioteca com mais de 80, 000 inibidores potenciais testados, apenas alguns mataram o Mtb. Os cientistas suspeitaram que um desses inibidores desligou a triptofano sintase do Mtb, mas eles precisavam ver o que estava acontecendo no nível molecular.
Cientistas de Argonne ouviram sobre o trabalho no Broad Institute, e os dois grupos começaram a colaborar. Argonne produziu a sintase de triptofano para o Broad Institute usar para testar o inibidor. Eles também determinaram a estrutura da sintase com o inibidor ligado a ela, expondo cristais compostos do complexo inibidor de proteína a raios-X de alta energia da Fonte Avançada de Fótons (APS) de Argonne e registrando como os elétrons na molécula espalharam a luz .
"A colaboração possibilitou que determinássemos a natureza alostérica do inibidor e as nuances de como a inibição funcionava, "disse Deborah Hung, professor da Harvard Medical School e codiretor do Programa de Doenças Infecciosas e Microbioma do Broad Institute.
A análise estrutural determinou que existem duas partes principais que constituem a triptofano sintase. Quando uma das regiões sinaliza para a outra que está pronta, a outra região produz uma substância química chamada indol. O indol, então, viaja através de um canal para a outra região da triptofano sintase, onde se combina com outra substância para criar o produto final, triptofano.
Uma ligeira instabilidade no canal permitiria que o indol viajasse para o outro lado, mas o inibidor é moldado para estabilizar o canal, impedindo o indol de se mover. Uma vez que o indol não pode alcançar o outro lado da proteína, o inibidor bloqueia a produção de triptofano.
"Na verdade, funciona de uma forma bastante sorrateira, "disse Andrzej Joachimiak, Diretor do Centro de Biologia Estrutural da Argonne e do Centro de Genômica Estrutural do Meio-Oeste. "O inibidor força a triptofano sintase a produzir o indol e o impede de cumprir sua função final."
Embora os pesquisadores estejam otimistas sobre o potencial deste inibidor como um antibiótico, ainda está longe de ser um fármaco disponível. Eles estudaram como o tecido humano reagiria à molécula e confirmaram que ela não é tóxica, mas experimentos em camundongos mostraram que o inibidor seria metabolizado pelo corpo muito rapidamente. Agora, pesquisas estão sendo feitas para refinar a estrutura do inibidor para que ele persista na corrente sanguínea por um longo período de tempo.