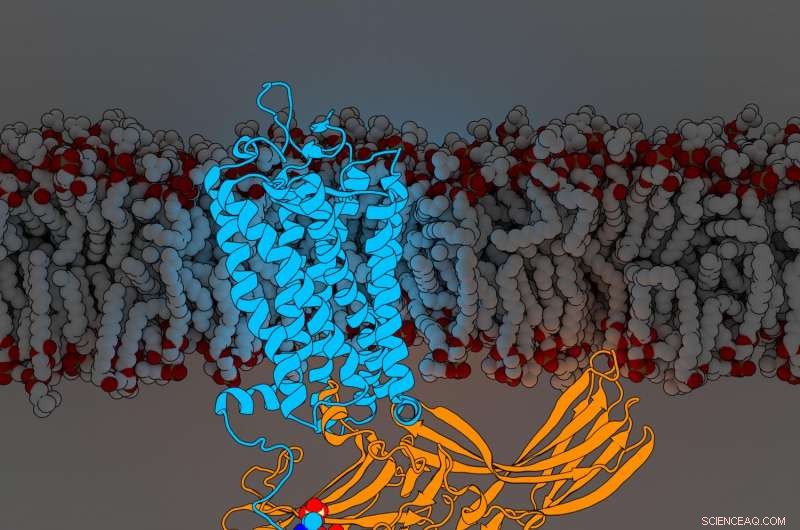
Rhodopsinarrestin. Crédito:Parker de Waal, Laboratório Xu, Van Andel Research Institute
Uma equipe liderada por cientistas do Van Andel Research Institute respondeu a uma questão de longa data que pode levar a medicamentos mais eficazes com menos efeitos colaterais para doenças que vão desde insuficiência cardíaca até câncer.
As evidências, publicado hoje em Célula , revelar pela primeira vez os componentes de um receptor acoplado à proteína G (GPCR) denominado rodopsina ligada a uma molécula sinalizadora chamada arrestina, ambas as peças cruciais da intrincada rede de comunicação celular do corpo. A nova descoberta refina ainda mais um marco de 2015 Natureza artigo que descreveu pela primeira vez a estrutura das duas moléculas em um complexo conjunto.
"Nossa estrutura revisada é como um roteiro com detalhes adicionais e características geográficas preenchidas, "disse o professor da VARI H. Eric Xu, Ph.D., o autor principal do novo estudo, bem como do artigo de 2015. "Por anos, o campo tem procurado responder exatamente como as arrestinas interagem com os GPCRs. Esperamos a resposta fornecida pelo nosso trabalho, no contexto da rodopsina, vai alimentar novas pesquisas e o design de melhores medicamentos, para o benefício final dos pacientes em todo o mundo. "
GPCRs são o maior grupo de receptores de superfície celular, e atuar como câmaras de compensação de informações, ligando-se a arrestinas ou outras moléculas de sinalização chamadas proteínas G para transmitir instruções críticas para inúmeras funções biológicas, incluindo crescimento e regulação hormonal. Essas características, juntamente com sua localização na superfície da célula, torná-los alvos atraentes para a terapia medicamentosa. Estima-se que 30% de todos os medicamentos atualmente no mercado têm como alvo os GPCRs.
"Uma vez que arrestinas e proteínas G medeiam diferentes respostas celulares, desenvolver drogas que ativam apenas uma dessas duas vias pode produzir menos efeitos colaterais para os pacientes, "disse Karsten Melcher, Ph.D., autor sênior do artigo e professor associado da VARI. "O conhecimento fornecido por nossa estrutura expandida pode percorrer um longo caminho na orientação do design dessas terapias."
Para determinar sua estrutura aumentada, O cientista pesquisador sênior do Xu Lab, Edward Zhou, Ph.D., reanalisou mais de 22, 000 imagens individuais coletadas para o estudo original de 2015 usando software aprimorado não disponível no momento. Ele revelou três componentes moleculares anteriormente ocultos chamados grupos fosforil na rodopsina e três bolsas correspondentes na arrestina que atuam como estações de acoplamento. O arranjo específico desses grupos fosforil - conhecidos como códigos de fosforilação - são necessários para que a rodopsina se ligue à arrestina, muito parecido com a combinação de um cofre. Depois de concluído, essa interação inicia um ramo de uma complexa rede de comunicação celular que regula funções em todo o corpo.
"A grande questão tornou-se então, 'Se isso está acontecendo com rodopsina e arrestina, isso acontece em todos os GPCRs? '", disse Parker de Waal, um aluno da Escola de Pós-Graduação do Instituto Van Andel e membro do laboratório de Xu. "Nossos resultados indicam que esses códigos - essas sequências específicas de grupos fosforil - são encontrados no todo ou em parte na maioria dos GPCRs. As descobertas ajudam a resolver com elegância uma questão de longa data em nosso campo; por que certos GPCRs ligam arrestinas melhor do que outros pode agora ser explicado pela existência de códigos de fosforilação. "
Não existia uma ferramenta para explorar a prevalência desses códigos em dados GPCR anotados, então de Waal criou um. Parte web GUI e parte ferramenta de linha de comando baseada em Python, O PhosCoFinder permitiu à equipe pesquisar rapidamente o conjunto total de todos os GPCRs conhecidos e prever códigos de fosforilação em potencial.
Como esperado, mais da metade dos 825 GPCRs escaneados pelo PhosCoFinder continham códigos de fosforilação em sua cauda C-terminal, uma parte do GPCR que ajuda a transferir informações do ambiente da célula para o interior da célula. A maioria dos GPCRs restantes também tinha códigos; Contudo, eles estavam localizados em áreas diferentes de suas caudas C-terminal, possivelmente afetando a maneira como eles se ligam às arrestinas. As próximas etapas, Xu diz, são investigar se essas descobertas são verdadeiras em todos os GPCRs e outras proteínas de superfície celular que interagem com a arrestina.
"Com biologia, sempre há mais de uma maneira de fazer as coisas, "Xu disse." Queremos seguir essas outras vias também na esperança de que elas nos ajudem a entender melhor esses mecanismos críticos. "