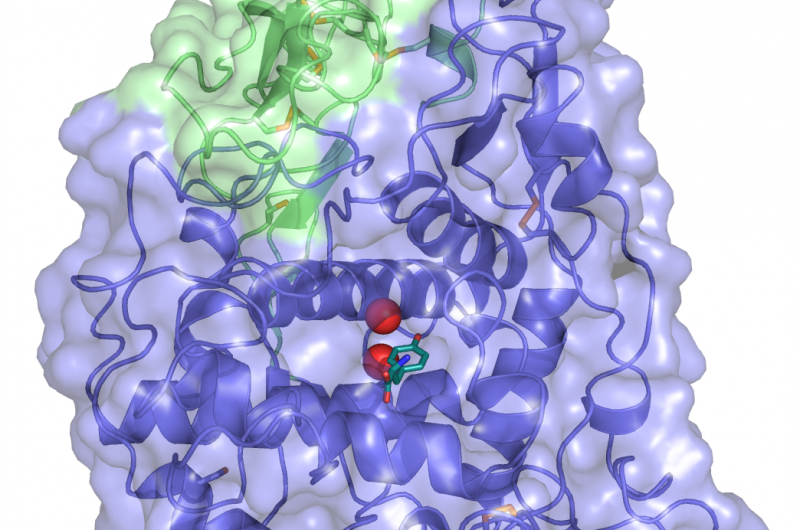
Uma estrutura cristalina de TYRP1. Tirosina (o substrato metabolizado por TYPR1, na cor deepteal) é ligado ao site ativo, onde os íons de metal zinco (esferas vermelhas) coordenam o papel funcional. Crédito:Montse Lopez
Novo avanço abre portas para o tratamento de doenças da pele relacionadas à melanina
Manchas resultantes da exposição excessiva ao sol e outros efeitos da produção disfuncional de melanina podem se tornar uma coisa do passado. Os cientistas resolveram a estrutura de uma das três enzimas que geram a melanina em humanos, abrindo portas para o design de compostos de clareamento para remover descolorações da pele. O estudo foi publicado em Angewandte Chemie
O verão costuma ser sinônimo de gente descansando nas praias tentando se bronzear. Com a idade e exposição frequente ao sol, algumas pessoas podem ter as chamadas "manchas senis" ou "manchas hepáticas", que são pequenas áreas escuras na pele. Livrar-se deles é um desafio e os pesquisadores e a indústria cosmética estão tentando encontrar uma maneira de removê-los a longo prazo.
Agora, uma equipe de pesquisadores do ESRF, A University of Groningen and Wageningen Food and Biobased Research (Holanda) acaba de decifrar uma das três enzimas que geram a melanina, o pigmento que dá a pele, cabelos e olhos de sua cor. Quando essas enzimas não funcionam adequadamente, elas criam distúrbios de pigmentação:manchas na pele, albinismo ou melanoma.
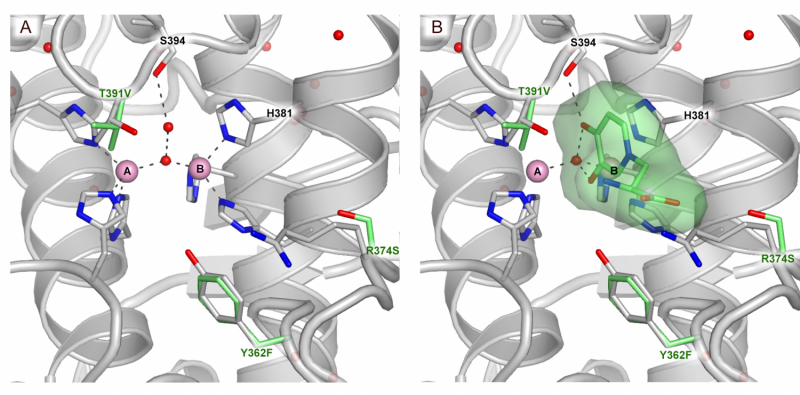
Um modo de ligação ao substrato do sítio ativo TYRP1. (A) Sítio ativo do TYRP1 (B) sítio ativo de TYRP1 com substrato ligado. Crédito:@Montse lopez
Até hoje, as estruturas dessas três enzimas eram desconhecidas, portanto, os cientistas têm usado enzimas de fungos ou plantas para sintetizar compostos direcionados aos humanos. O desafio de resolver essas estruturas está no fato de que os cientistas não sabem como essas enzimas funcionam para produzir melanina e nunca conseguiram purificar a versão humana em grandes quantidades para estudá-las.
Descobertas inesperadas
Xuelei Lai, primeiro autor do estudo, focado em enzimas humanas em vez de enzimas vegetais. Ele explica que "conseguimos purificar e cristalizar a tirosinase e a proteína relacionada à tirosinase 1 (TYRP1) e resolvemos a estrutura do TYRP1. Esta é a primeira estrutura disponível para uma enzima melanogênica de mamífero. Acreditamos que se seguirmos a mesma procedimento, provavelmente poderíamos resolver a estrutura da tirosinase e da proteína 2 relacionada à tirosinase, portanto, esses resultados parecem muito promissores em nossa busca para desvendar a complexa maneira como a melanina é gerada ".
Os cientistas também revelaram um resultado inesperado:eles descobriram que o TYRP1 precisa de zinco para funcionar, ao contrário da crença estabelecida na comunidade de que esta enzima precisa de cobre. "Ainda não sabemos exatamente qual é o papel do zinco na interação com o TYRP1 e precisamos de pesquisas extensas para descobrir isso", explica Montse Soler López, autor correspondente do artigo e cientista do ESRF.

Montse Soler Lopez, autor correspondente, Cientista do ESRF no laboratório do ESRF. Crédito:@ESRF
A chave deste trabalho é que ele fornece um verdadeiro modelo para o design de compostos clareadores para remover manchas que aparecem na pele das pessoas devido ao sol ou ao envelhecimento. Bauke W. Dijkstra, também autor correspondente e ex-Diretor de Pesquisa do ESRF, explica a relevância de seu trabalho no contexto industrial:“As empresas de cosméticos estão investindo um grande esforço nisso, portanto, esperamos que nossas descobertas representem um grande avanço no campo ".