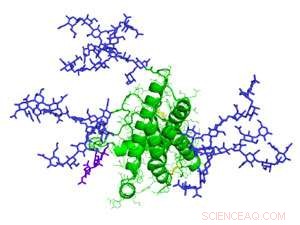
Um modelo de eritropoetina, uma glicoproteína envolvida na produção de glóbulos vermelhos. Os glicanos são indicados em roxo. Crédito:Mark Wormald, Oxford Glycobiology Institute
Mais de duas semanas em 2004, Song Zhiwei testemunhou a morte lenta de uma colônia de células. Canção, um bioengenheiro no A * STAR Bioprocessing Technology Institute (BTI), banhou uma placa de células de ovário de hamster chinês (CHO) com lectina, uma proteína tóxica derivada de plantas. Ele então observou os milhões de células encolherem para uma dúzia de sobreviventes. Eles pareciam normais, mas Song sabia que eles tinham superpoderes. O segredo estava escondido no adoçamento.
Os açúcares são essenciais para a vida. Entre as classes mais importantes de açúcares estão aqueles que estão quimicamente ligados às proteínas. Essas glicoproteínas estão envolvidas em tudo, desde o reconhecimento de invasores do sistema imunológico até a lubrificação das membranas e estimulação da tireóide. Eles também alimentam uma indústria farmacêutica em expansão - muitos medicamentos domésticos contêm glicoproteínas, e as empresas de biotecnologia investem recursos significativos na otimização da adição de açúcar dessas proteínas para melhorar sua bioatividade e potência terapêutica.
A lectina é conhecida por se ligar a açúcares pendurados nas extremidades das glicoproteínas. No experimento de Song, apenas células CHO mutantes que não produziram esses açúcares de ligação poderiam sobreviver ao tratamento com lectina. Essa abordagem de 'ver o que gruda' é um método estabelecido de identificação de mutantes que podem ser subsequentemente produzidos em massa pela indústria de biotecnologia.
Song passou os próximos dois anos conduzindo experimentos de cultura de células, estudos de biologia molecular e testes genéticos para provar que as células eram na verdade mutantes. Determinar a estrutura exata das glicoproteínas mutantes exigiu a ajuda de seu colega Lee May May, que chefiou o grupo de análise no BTI. May usou ferramentas de espectrometria de massa para determinar a estrutura bioquímica exata das proteínas produzidas pelas células mutantes de Song, revelando que eles careciam de açúcares-chave. Song havia criado as primeiras linhas de células mutantes de açúcar aplicáveis à fabricação de biotecnologia.
A colaboração desde então se expandiu para uma parceria mundialmente conhecida entre bioengenheiros e bioanalistas na A * STAR, avanço da compreensão do papel dos açúcares nas doenças.
Conversa doce
Os açúcares são a menor e mais simples forma de carboidrato, feito de unidades moleculares de carbono simples ou conectadas, hidrogênio e oxigênio. Nosso sangue contém centenas de tipos de açúcares:alguns flutuando livremente, mas muitos mais ligados a proteínas, como decorações em uma árvore de Natal. Quase 70 por cento das proteínas em nosso corpo são glicosiladas, o que significa que eles não funcionarão sem seu equipamento açucarado. O arranjo específico de açúcares, ou glicanos, em uma glicoproteína determina como uma proteína se dobra e interage com outras moléculas, altera sua solubilidade e às vezes até mesmo as mensagens que transmite às células. "A célula gasta uma enorme quantidade de energia para colocar açúcares nas proteínas, "diz Pauline Rudd, um veterano no campo da glicobiologia, que se juntou à equipe de análise da BTI em 2015. "Se você não tinha açúcar, você não sobreviveria. "
Os pesquisadores descobriram o papel crítico das glicoproteínas no início do século XX. Um médico austríaco, Karl Landsteiner, notou que o sangue humano se misturou com o sangue dos animais, ou mesmo outros humanos, forma aglomerados. Esses aglomerados podem obstruir os vasos ou se abrir para liberar proteínas tóxicas no corpo. Contudo, Landsteiner notou que algumas misturas não coagularam. Esta descoberta o levou à classificação do grupo sanguíneo ainda usada hoje - A, B, AB e O - e ganhou o Prêmio Nobel de Fisiologia ou Medicina em 1930. Na década de 1950, os pesquisadores determinaram que os açúcares expostos na superfície dos glóbulos vermelhos determinavam a qual grupo sanguíneo eles pertenciam.
O exame de sangue incentivou a pesquisa de glicoproteínas. Na década de 1990, os biólogos foram apanhados pela mania da genética. A cura para tudo, eles postularam, estava escondido em nosso DNA. "Dizia-se que os genes eram a causa de tudo, "diz Rudd, que viu o financiamento para a glicobiologia diminuir. Entre 1998 e 2000, US $ 3,5 bilhões foram gastos globalmente em pesquisas genômicas, incluindo a iniciativa de sequenciar todo o genoma humano. "Havia muitas informações, mas não nos fornecia um caminho direto para a compreensão das doenças, "diz Rudd." As pessoas começaram a sugerir que talvez os genes não façam nada, exceto codificar proteínas.
Os cientistas mudaram sua atenção para os muitos outros estágios da atividade biológica até que chegaram novamente aos açúcares.
"O DNA é a primeira camada de informação. Essa informação é transcrita em RNA, que envia uma mensagem que é traduzida em uma proteína com uma função, "diz Song." Carboidratos, ou açúcares, são a última camada de informação biológica. "
Saber a importância dos açúcares não os tornava mais fáceis de estudar. DNA e proteínas são estruturas essencialmente lineares que "se enrolam em formas extravagantes, "diz Rudd. Os açúcares se ramificam em várias cadeias." Eles são como grandes árvores penduradas nas laterais das proteínas. "Levaria vários anos antes que os açúcares pudessem ser analisados com a precisão e velocidade dos genes e proteínas.
Sacudir
Em 1989, um terremoto atingiu a Califórnia. Rudd se lembra bem. Ela estava profundamente envolvida em uma colaboração entre o Oxford Glycobiology Institute (liderado pelo Diretor Raymond Dwek) e uma equipe de pesquisa em Londres, em busca de mudanças na forma como as proteínas são glicosiladas em pacientes com doenças autoimunes. Ela estava analisando 600 amostras da proteína imunoglobulina G (IgG), usando um gel especial para filtrar os açúcares. A fábrica que produzia esse gel foi destruída pelo terremoto.
Quando a fábrica foi reconstruída, seu gel não era o mesmo. "Foi completamente inútil, "lembra Rudd." Eu estava arrancando meus cabelos tentando fazer com que essas 600 amostras fossem analisadas. "
Necessidade gera invenção, então Rudd olhou em volta e notou as colunas de cromatografia líquida (LC) que ela estava usando para classificar as proteínas. Ela enfiou nas colunas uma seringa cheia de uma mistura de açúcares liberados de suas amostras de glicoproteínas. O dispositivo LC filtrou os açúcares em uma resolução muito maior do que o processo de gel. "Nós nunca voltamos, " ela diz.
Desde então, Rudd colaborou com parceiros privados e institucionais para acelerar, automatizar e melhorar a especificidade das técnicas de classificação e caracterização de açúcares de uma amostra. O que costumava levar um ano, agora pode ser feito em um dia. O fluxo de trabalho, bioinformática e bancos de dados desenvolvidos pela equipe de Rudd no Instituto Nacional de Pesquisa e Treinamento em Bioprocessamento (Dublin, Irlanda) foram incorporados à plataforma de espectrometria de massa / cromatografia líquida acoplada analítica UNIFI da Waters Corporation, o que significa que grande parte da complexidade da glicoanálise agora é automatizada. Portanto, a glicoanálise entrou em uma nova era de glicômica, trazendo-o para mais perto do universo de big data da genética, transcriptômica e proteômica.
"Agora podemos olhar para grandes coortes de amostras para entender mais sobre as doenças e apoiar o desenvolvimento e a produção biológica, "diz Terry Nguyen-Khuong, que chefia o grupo de análise da BTI. Desde que se juntou a Rudd, A * STAR expandiu seu portfólio de análises para ampliar os açúcares e identificar sua localização exata, blocos básicos de construção e estruturas de ligação.
Glicoproteínas Pharming
As glicoproteínas abastecem uma indústria biofarmacêutica de US $ 163 bilhões, cuja eficácia pode ser ditada pelos açúcares. Por exemplo, quando o hormônio eritropoietina é adornado com açúcares de ácido siálico, é dez vezes mais eficaz na estimulação da produção de glóbulos vermelhos em pacientes anêmicos do que o hormônio sozinho.
No negócio de glicoproteínas, As células CHO abrangem toda a força de trabalho. Eles podem produzir quaisquer proteínas que a indústria de biotecnologia exija, e podem revestir as proteínas da mesma forma que os humanos fazem.
Antes de Song criar seus primeiros mutantes de células CHO, ninguém foi capaz de controlar a glicosilação de proteínas em linhas de células que podem ser produzidas em massa. O grupo de Pamela Stanley nos Estados Unidos vinha ajustando a glicosilação de células CHO por anos usando linhagens de células que viveram e morreram em uma placa de Petri plana, alimentado com sangue de vaca rico em proteínas. Em vez disso, Song desenvolveu mutantes usando células que ele sabia que poderiam se replicar indefinidamente enquanto giravam em 20 esféricos, Biorreatores de 000 litros usados em fábricas biofarmacêuticas - sem aditivos bovinos.
Ele nomeou a linha celular CHO-glicosilação mutante 1 (GMT-1), e desde então, mais de vinte sucessores seguiram em ordem numérica. Quando surgiram ferramentas que tornaram a edição de genes tão simples quanto cortar e colar palavras em uma tela de computador, ele os usou para gerar mais mutantes.
No GMT-3, ele deletou um gene necessário para fixar os açúcares da fucose em proteínas. As glicoproteínas GMT-9 não possuem os açúcares fucose e galactose; e GMT-17 não tem fucose, galactose e ácido siálico. A ausência desses açúcares pode ditar a potência dos medicamentos. As células de Song produzem anticorpos que são até cem vezes melhores em matar células cancerosas do que seus medicamentos equivalentes no mercado, como o rituximab (marca Rituxan) para tratar a leucemia. "As linhas celulares são comparáveis às linhas industriais e estão prontas para comercialização, "diz Song, que administra um subsídio de S $ 11 milhões para glicômicos chamado GlycoSing desde 2014. Os tratamentos com esses anticorpos aprimorados significariam doses significativamente reduzidas.
Em 2008, Andre Choo, um pesquisador do BTI, desenvolveram os primeiros anticorpos que poderiam matar especificamente células-tronco embrionárias, aliviar as preocupações sobre as células que formam tumores em pacientes transplantados. Os anticorpos já foram licenciados para várias empresas.
Muitas doenças têm um perfil de açúcar distinto, um conceito que Choo começou a explorar para a terapêutica do câncer. Ele rastreia anticorpos que visam especificamente moléculas de açúcar aberrantes na superfície das células cancerosas, trabalhando com a equipe de Rudd e Nguyen-Khuong para analisá-los.
Recentemente, este ano, sua equipe gerou um anticorpo que reconhece açúcares expressos em células de câncer de ovário. "No passado, geraríamos um anticorpo sem realmente saber o que ele visava, agora estamos focados em tentar obter esses anticorpos anti-glicano. "
Na A * STAR, a pesquisa se expandiu para a dengue, o vírus Zika e as doenças cardíacas. "Todas as principais áreas da medicina - câncer, doenças infecciosas e problemas inflamatórios - estão relacionados às glicoproteínas, "diz Song, cujos mutantes poderiam potencialmente curar essas doenças.