
Os químicos do Brookhaven Lab, Ping Liu e José Rodriguez, ajudaram a caracterizar os detalhes estruturais e mecanísticos de um novo catalisador de baixa temperatura para a produção de gás hidrogênio de alta pureza a partir de água e monóxido de carbono. Crédito:Laboratório Nacional de Brookhaven
Os cientistas desenvolveram um novo catalisador de baixa temperatura para a produção de gás hidrogênio de alta pureza e, ao mesmo tempo, o uso de monóxido de carbono (CO). A descoberta descrita em um artigo definido para publicar online no jornal Ciência na quinta feira, 22 de junho 2017 poderia melhorar o desempenho das células de combustível que funcionam com combustível de hidrogênio, mas podem ser envenenadas por CO.
"Este catalisador produz uma forma mais pura de hidrogênio para alimentar a célula de combustível, "disse José Rodriguez, um químico do Laboratório Nacional de Brookhaven do Departamento de Energia dos EUA (DOE). Rodriguez e colegas da Divisão de Química de Brookhaven - Ping Liu e Wenqian Xu - estavam entre a equipe de cientistas que ajudaram a caracterizar os detalhes estruturais e mecanísticos do catalisador, que foi sintetizado e testado por colaboradores da Universidade de Pequim em um esforço liderado pelo professor de química Ding Ma.
Como o catalisador opera em baixa temperatura e baixa pressão para converter água (H2O) e monóxido de carbono (CO) em gás hidrogênio (H2) e dióxido de carbono (CO2), também poderia reduzir o custo de execução da chamada reação de "deslocamento do gás água".
"Com baixa temperatura e pressão, o consumo de energia será menor e a configuração experimental será mais barata e mais fácil de usar em ambientes pequenos, como células de combustível para carros, "Rodriguez disse.
A conexão de carboneto de ouro
O catalisador consiste em aglomerados de nanopartículas de ouro em camadas sobre um substrato de carboneto de molibdênio. Essa combinação química é bastante diferente dos catalisadores à base de óxido usados para alimentar a reação de deslocamento do gás água em instalações industriais de produção de hidrogênio em grande escala.
"Os carbonetos são mais reativos quimicamente do que os óxidos, "disse Rodriguez, "e a interface de carboneto de ouro tem boas propriedades para a reação de deslocamento de gás água; ela interage melhor com água do que metais puros."
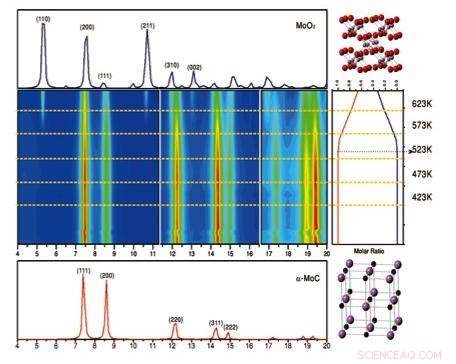
Wenqian Xu e José Rodriguez do Laboratório Brookhaven e Siyu Yao, em seguida, um estudante da Universidade de Pequim, mas agora um pesquisador de pós-doutorado em Brookhaven, conduziu estudos de difração de raios-X operando do catalisador de carboneto de ouro-molibdênio em uma faixa de temperaturas (423 Kelvin a 623 K) na National Synchrotron Light Source (NSLS) no Laboratório de Brookhaven. O estudo revelou que em temperaturas acima de 500K, carboneto de molibdênio se transforma em óxido de molibdênio, com redução da atividade catalítica. Crédito:Laboratório Nacional de Brookhaven
"O grupo da Universidade de Pequim descobriu um novo método sintético, e isso foi um grande avanço, "Rodriguez disse." Eles encontraram uma maneira de obter uma fase específica - ou configuração dos átomos - que é altamente ativa para esta reação. "
Os cientistas de Brookhaven desempenharam um papel fundamental na decifração das razões para a alta atividade catalítica dessa configuração. Rodriguez, Wenqian Xu, e Siyu Yao (então um estudante da Universidade de Pequim, mas agora um pesquisador de pós-doutorado em Brookhaven) conduziram estudos estruturais usando difração de raios-X na Fonte de Luz Síncrotron Nacional (NSLS) enquanto o catalisador estava operando em condições industriais ou técnicas. Esses experimentos operando revelaram detalhes cruciais sobre como a estrutura mudou sob diferentes condições de operação, inclusive em diferentes temperaturas.
Com esses detalhes estruturais em mãos, Zhijun Zuo, um professor visitante em Brookhaven da Universidade de Tecnologia de Taiyuan, China, e o químico de Brookhaven Ping Liu ajudou a desenvolver modelos e uma estrutura teórica para explicar por que o catalisador funciona dessa maneira, usando recursos computacionais no Brookhaven's Center for Functional Nanomaterials (CFN).
"Modelamos diferentes interfaces de carboneto de ouro e molibdênio e estudamos o mecanismo de reação para identificar exatamente onde as reações ocorrem - os locais ativos onde os átomos estão se ligando, e como os laços estão rompendo e reformando, " ela disse.
Estudos adicionais no Oak Ridge National Laboratory's Center for Nanophase Materials Sciences (CNMS), a Advanced Light Source (ALS) no Lawrence Berkeley National Laboratory, e duas instalações de pesquisa de síncrotron na China aumentaram a compreensão dos cientistas.
"Esta é uma reação complexa de várias partes, "disse Liu, mas ela observou um fator essencial:"A interação entre o ouro e o substrato de carboneto é muito importante. O ouro geralmente liga as coisas de maneira muito fraca. Com esse método de síntese, obtemos uma aderência mais forte do ouro ao carboneto de molibdênio de uma forma controlada."
Essa configuração estabiliza o intermediário chave que se forma à medida que a reação prossegue, e a estabilidade desse intermediário determina a taxa de produção de hidrogênio, ela disse.
A equipe de Brookhaven continuará a estudar este e outros catalisadores de carboneto com novos recursos na National Synchrotron Light Source II (NSLS-II), uma nova instalação que foi inaugurada no Brookhaven Lab em 2014, substituindo NSLS e produzindo raios-x que são 10, 000 vezes mais brilhante. Com esses raios-x mais brilhantes, os cientistas esperam capturar mais detalhes da química em ação, incluindo detalhes dos intermediários que se formam ao longo do processo de reação para validar as previsões teóricas feitas neste estudo.