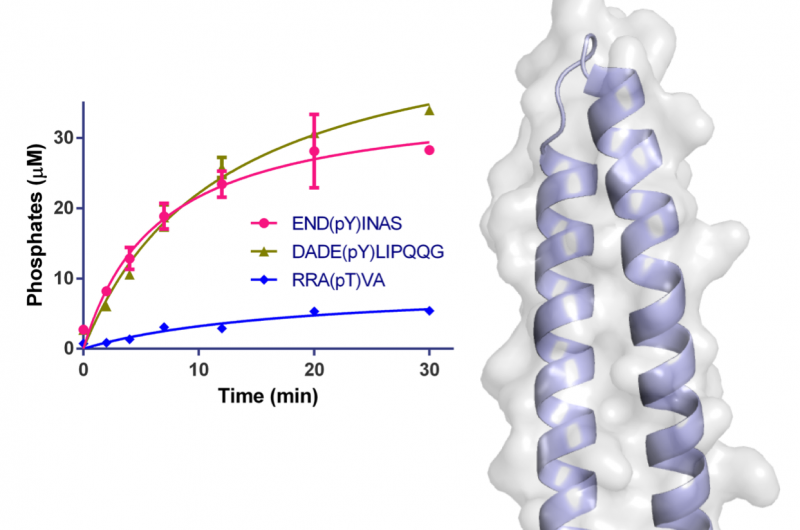
Figura 1:Estrutura de WipA em representação de cartoon e superfície semitransparente. O domínio da fosfatase é representado em vermelho-verde e a bobina anexada em azul claro. Os resíduos envolvidos na catálise são representados como bastões em torno do Mn2 + e dos íons fosfato. A superfície é mostrada em cinza claro. O gráfico inserido exibe a desfosforilação ao longo do tempo de peptídeos específicos usando 20 nM de WipA. Crédito:Diamond Light Source
Cientistas de Londres elucidaram a estrutura de um grande fragmento de uma proteína bacteriana, conhecido como WipA, que é secretado pela Legionella pneumophila. O trabalho, publicado recentemente no Journal of Biological Chemistry , mostraram que a proteína possuía algumas características fascinantes que forneceram informações valiosas sobre seu mecanismo de ação.
A bactéria, L. pneumophila, causa uma forma grave de pneumonia conhecida como doença do legionário. A patogenicidade dessa bactéria depende da secreção de mais de 300 proteínas efetoras no hospedeiro. Um desses efetores, WipA, chamou a atenção por sua dependência de um complexo de chaperonas (necessário para garantir a funcionalidade da proteína) para sua secreção e seu papel desconhecido na patogenicidade.
Duas das linhas de luz de Cristalografia Macromolecular (MX) (I02 e I04) na Diamond Light Source foram usadas para iniciar o estudo e resolver a estrutura cristalina de um grande fragmento de WipA. A estrutura mostrou que a proteína possuía uma dobra de serina / treonina fosfatase que surpreendentemente tinha como alvo os peptídeos tirosina-fosforilados. Adicionalmente, foi levantada a hipótese de que WipA poderia fazer a transição de um estado homodimérico para um estado heterodimérico para interagir com um alvo hospedeiro fosforilado em tirosina. As descobertas ajudarão a esclarecer os mecanismos moleculares que sustentam a patogenicidade da Legionella e podem auxiliar no desenvolvimento de inibidores.
Vapor infectado
A doença do legionário pode ser letal entre os membros vulneráveis de uma população, e é particularmente perigoso durante surtos hospitalares. Uma das principais fontes de infecção por Legionella é o vapor de água em sistemas de ar condicionado, caldeiras, banhos quentes e chuveiros.
Uma vez que o hospedeiro respira o vapor infectado, as bactérias entram nos pulmões e procuram células brancas do sangue, conhecidos como macrófagos. As bactérias são engolfadas pelos macrófagos, mas em vez de ser morto por eles, a bactéria habilmente emprega um sistema de secreção do tipo IVb para secretar uma grande variedade de proteínas efetoras na célula hospedeira, a fim de capturar a maquinaria celular do hospedeiro e garantir a sobrevivência bacteriana.
Triagem extensa
O fragmento principal de WipA foi cristalizado com sucesso removendo ambos os terminais da sequência que previa as regiões não estruturadas. Os cristais foram inicialmente analisados nas linhas de luz I02 e I04 de Diamond, enquanto o trabalho foi concluído na linha de luz PetraIII P13 no Laboratório Europeu de Biologia Molecular em Hamburgo.
Na Diamond, a linha de luz Microfocus MX (I04) foi usada para triagem de cristal e I02 foi usado para coletar dados de difração. O Dr. Nikos Pinotsis é um pesquisador de pós-doutorado em biologia estrutural e molecular no laboratório do Professor Gabriel Waksman no Instituto de Biologia Estrutural e Molecular em Birkbeck / UCL e co-investigador do estudo. Ele explicou sua abordagem, "Mesmo que o tamanho dos cristais WipA fosse suficiente para experimentos de difração de cristal único, a maioria deles exibia redes múltiplas e / ou desordenadas, portanto, a triagem extensiva foi crítica para a aquisição bem-sucedida de dados de alta resolução e qualidade. Otimizamos nossas estratégias de coleta de dados para um tamanho de feixe que se ajustasse suficientemente às dimensões mais curtas do cristal e otimizamos o feixe maximizando o feixe e o tempo de exposição, minimizando os danos por radiação. "
Primeiro de sua classe
A estrutura do fragmento WipA exibiu uma dobra de fosfatase montada em um grampo de cabelo helicoidal, que foi o primeiro de sua classe. O núcleo desta estrutura se assemelhava a uma proteína fosfatase serina / treonina, mas experiências bioquímicas mostraram inesperadamente que ele tinha uma preferência por substratos fosforilados com tirosina. Esta observação surpreendente só tinha sido notada uma vez antes entre várias centenas de fosfatases semelhantes.
O Dr. Pinotsis explicou a relevância dos resultados:"Uma vez que o alvo hospedeiro para desfosforilação por WipA é conhecido, inibidores podem ser projetados para inibir essa interação. Embora seja possível que essas descobertas possam levar ao desenvolvimento de antibacterianos, eles contribuem principalmente para uma compreensão geral da sobrevivência e patogenicidade de uma bactéria, que é um primeiro passo muito importante para estabelecer tratamentos de longa duração contra infecções. "
A equipe planeja identificar o alvo WipA nas células hospedeiras e continuará a explorar outras interações proteína-proteína para fornecer uma visão mais completa do mecanismo de infecção de Legionella.