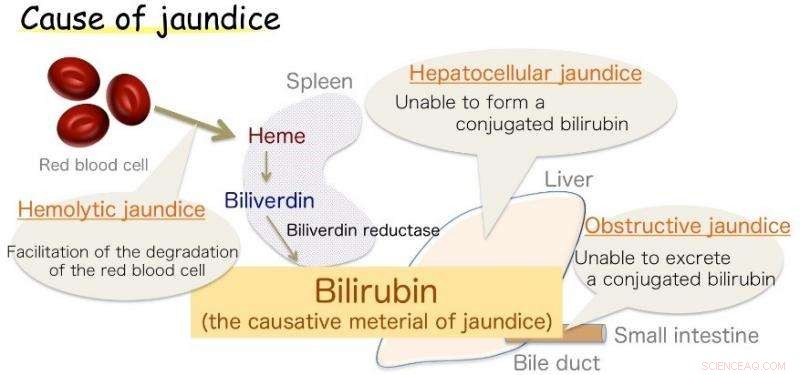
Fig.1:Causa da icterícia. A bilirrubina é o material causador da icterícia. Crédito:Universidade de Osaka
Uma equipe de pesquisa japonesa envolvendo a Universidade de Osaka investigou a biliverdina redutase, a enzima que produz a bilirrubina - uma substância ligada à icterícia - a partir da biliverdina (BV). Duas moléculas de BV foram encontradas no local da reação enzimática, em um arranjo empilhado incomum. Os experimentos de mutação confirmaram qual aminoácido enzimático era necessário para a produção de bilirrubina. No mecanismo proposto, este aminoácido transfere hidrogênio para uma molécula de BV, usando o outro BV como um conduíte. Isso auxilia na busca por medicamentos anti-icterícia.
Osaka - Icterícia, marcado pelo amarelecimento da pele, é comum em bebês, mas também um sintoma de várias doenças adultas. Esta descoloração é causada pelo excesso de bilirrubina (BR), a substância que dá à bile sua coloração amarela. Contudo, BR também é um antioxidante vital, que em níveis saudáveis protege as células contra danos por peróxido. Sua produção no corpo, no entanto, tem sido uma fonte de incerteza.
Agora, uma colaboração de pesquisa japonesa envolvendo a Universidade de Osaka acredita ter a resposta. Já se sabe que o BR é produzido a partir de um produto químico relacionado, biliverdina (BV), pela enzima biliverdina redutase (BVR). A enzima envolve o BV e transfere dois átomos de hidrogênio - um positivo e um negativo - para produzir o antioxidante amarelo. Contudo, os biólogos não conseguiram estabelecer qual parte da enzima estava quimicamente envolvida no processo (o sítio ativo), ou de onde veio o hidrogênio positivo. As descobertas foram relatadas recentemente em Nature Communications .
"Estudos anteriores usaram BVR de ratos, e nunca poderia cristalizar a enzima bem o suficiente para determinar como ela se liga ao BV, "diz o co-autor do estudo Keiichi Fukuyama." Percebemos que a mesma enzima na bactéria Synechocystis tinha uma forma de dobra quase idêntica, mas era mais fácil de examinar por cristalografia de raios-X. "
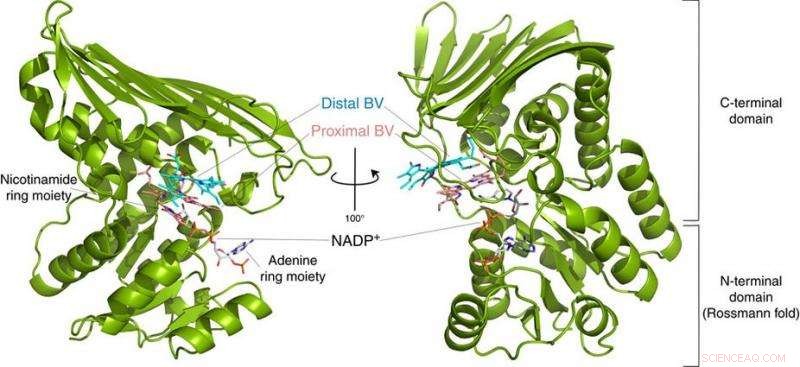
Fig.2:Estrutura do BVR. Esta estrutura revelou que o BVR se liga a dois substratos de biliverdina (Distal BV e Proximal BV) ao mesmo tempo. Crédito:Universidade de Osaka
Para sua surpresa, os pesquisadores encontraram duas moléculas de BV - uma empilhada sobre a outra - no sítio ativo, mesmo que apenas um seja convertido para BR. A partir dos dados de raios-X, eles deduziram por que dois eram necessários. O primeiro BV, por causa da direção que enfrenta para receber o hidrogênio negativo, não pode aceitar o hidrogênio positivo diretamente da enzima. Em vez de, o segundo BV atua como um conduíte de hidrogênio para permitir o processo, mas não é convertido em BR.
Da estrutura, os pesquisadores propuseram qual dos 328 aminoácidos da enzima realmente fornece o átomo de hidrogênio positivo. Então, eles realizaram experimentos em que as enzimas foram mutadas para remover especificamente esse aminoácido, enquanto deixa os outros intactos. As enzimas resultantes, seja de bactérias, ratos, ou humanos, foram virtualmente incapazes de produzir BR. Outros experimentos confirmaram que as enzimas de rato e humana também usaram duas moléculas de BV, assim como as bactérias.
"Esse empilhamento perfeito de duas moléculas de substrato durante os processos enzimáticos é muito raro, "Fukuyama diz." Uma melhor compreensão da produção de BR não é apenas emocionante para a bioquímica, mas deve nos ajudar a desenvolver medicamentos para doenças marcadas por icterícia grave por excesso de BR, como hepatite. "
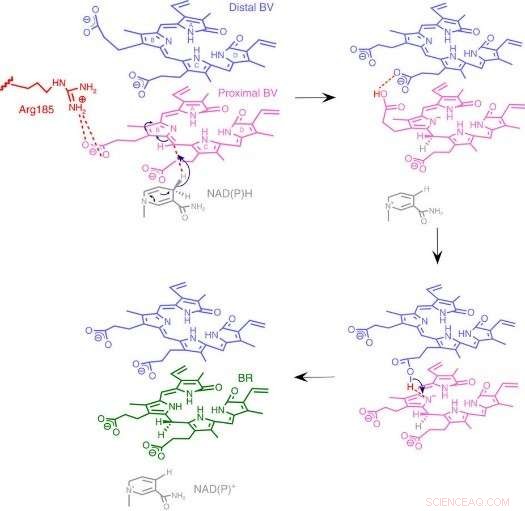
Fig.3:Mecanismo da reação BVR. Nós propomos um mecanismo de reação único baseado em uma nova estrutura de enzima na qual dois substratos empilhados se ligam a uma bolsa catalítica. Crédito:Universidade de Osaka