Drogas que contêm ouro são usadas há séculos para tratar doenças como a artrite reumatóide. Além disso, eles podem ser eficazes contra o câncer e o HIV. Um mecanismo pelo qual eles funcionam pode ocorrer porque os íons de ouro forçam os íons de zinco para fora dos dedos de zinco - em loop, domínios de proteína de ligação de ácido nucleico. Pesquisadores americanos caracterizaram esses "dedos de ouro" usando espectrometria de massa de mobilidade iônica. Conforme relatado no jornal Angewandte Chemie , eles identificaram os locais exatos de ligação de ouro.
"Os íons de zinco nos dedos de zinco se ligam a quatro átomos de enxofre ou nitrogênio dos resíduos de cisteína e histidina da proteína, "explica Nicholas P. Farrell, da Virginia Commonwealth University (Richmond, EUA). "Os íons de ouro se ligam a apenas dois fragmentos de aminoácidos e mudam a conformação da proteína. Os" dedos de ouro "não são mais capazes de se ligar aos ácidos nucléicos, que pode ser terapeuticamente útil. "
Embora haja uma variedade de locais de ligação potenciais para íons metálicos, cada metaloproteína geralmente prefere uma única conformação. Anteriormente, não era possível determinar onde os locais de ligação específicos estavam em uma mistura de conformadores. Farrell e sua equipe examinaram agora de perto dois dedos de ouro. De acordo com Farrell, "substituir o zinco no dedo de zinco 3 do fator de transcrição Sp1 leva a apenas uma única espécie de dedo de ouro." Os pesquisadores identificaram isso como tendo uma ligação Cys-Au-His linear. No caso da proteína do nucleocapsídeo do HIV, que desempenha um papel crítico na replicação do vírus, "colocar ouro no dedo de zinco 2 da proteína (NCp7-F2), leva a três espécies diferentes de dedos de ouro com motivos lineares Cys-Au-Cys, um dos quais é claramente predominante. "
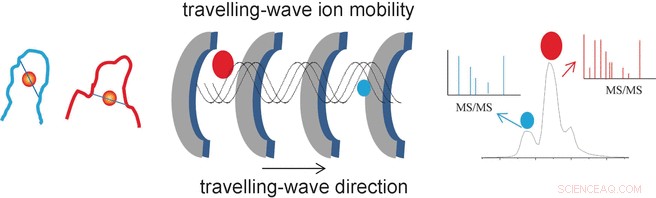
O sucesso dos pesquisadores deriva do uso de um método analítico especial chamado espectrometria de massa de mobilidade de íons de ondas viajantes (TWIM-MS). Nesta técnica, as moléculas a serem analisadas são ionizadas e os íons acelerados por um campo elétrico em um gás. As colisões com as moléculas de gás fazem com que os íons sejam retardados. Grande, moléculas volumosas são mais lentas do que pequenas, compactos porque colidem com mais frequência. Isso torna possível diferenciar e separar isômeros também, porque embora tenham a mesma massa, suas geometrias diferentes resultam em mobilidade diferente. Uma vez separados de acordo com sua mobilidade, os íons individuais podem agora ser fragmentados por dissociação induzida por colisão (CID) e os fragmentos medidos novamente por espectrometria de massa. Isso torna possível caracterizar peptídeos mais curtos que permanecem ligados ao ouro.
"Desta maneira, fomos capazes de identificar os locais de ligação e modos específicos para os dedos de zinco modificados com ouro NCp7-F2 e Sp1-F3, ", diz Farrell." A espectrometria de massa de mobilidade iônica, portanto, fornece informações importantes sobre as mudanças na geometria causadas pela troca de zinco nas proteínas de dedo de zinco, bem como a seletividade e reatividade de tais reações. Isso poderia ser benéfico na busca de novos antivirais e antitumorais baseados em metais. "