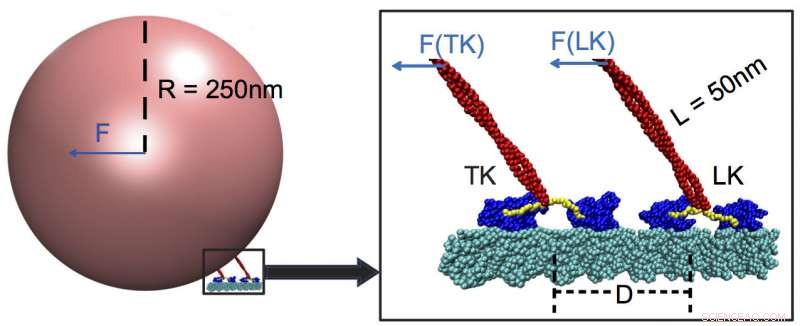
 p Duas cinesinas de suporte de carga, pois transportam carga ao longo de um microtúbulo (ciano). Pesquisadores da Rice University e da University of Houston determinaram que as proteínas motoras respondem melhor a forças fortes e quase nada a forças fracas, mesmo aqueles aplicados por motores acoplados à mesma carga. Neste exemplo, a cinesina principal (LK) carrega a maior parte da carga, com cabeçotes de motor (azul) ativados por um ligador de pescoço (amarelo) que se conecta ao talo (vermelho) e detecta a presença da carga. Crédito:Center for Theoretical Biological Physics / Rice University
p Duas cinesinas de suporte de carga, pois transportam carga ao longo de um microtúbulo (ciano). Pesquisadores da Rice University e da University of Houston determinaram que as proteínas motoras respondem melhor a forças fortes e quase nada a forças fracas, mesmo aqueles aplicados por motores acoplados à mesma carga. Neste exemplo, a cinesina principal (LK) carrega a maior parte da carga, com cabeçotes de motor (azul) ativados por um ligador de pescoço (amarelo) que se conecta ao talo (vermelho) e detecta a presença da carga. Crédito:Center for Theoretical Biological Physics / Rice University
p Se você é a proteína motora desde o início, esteja preparado para fazer o puxão pesado. p Essa é uma conclusão de um estudo conduzido pela Rice University sobre os mecanismos que impulsionam as cinesinas, proteínas motoras que transportam carga dentro das células. O estudo mostra que é preciso muita força contrária para desacelerar uma determinada cinesina. A proteína também não recebe muita ajuda de colegas que cuidam da retaguarda.
p O estudo teórico detalhado no
Proceedings of the National Academy of Sciences e liderado pelo pesquisador de pós-doutorado de Rice, Qian Wang, foi um esforço colaborativo dos laboratórios de três professores da Rice e um da Universidade de Houston, todos trabalhando sob a égide do Centro de Física Teórica Biológica de Rice (CTBP).
p Eles esperam aumentar o conhecimento sobre os burros de carga pouco compreendidos dentro das células que são essenciais para a divisão celular e também para o transporte de carga. Cinesinas defeituosas ou deficientes estão implicadas na doença de Charcot-Marie-Tooth e em algumas doenças renais.
p Por meio de simulações de computador, os pesquisadores fornecem os primeiros detalhes de nível molecular de como as cinesinas respondem às forças externas, enquanto confirmam experimentos anteriores do co-autor Michael Diehl, que mostraram que equipes de cinesinas funcionam melhor apenas quando estão próximas e podem puxar na mesma direção.
p "Nós mais ou menos entendemos os motores individuais, "disse o biofísico e co-autor de Rice, Anatoly Kolomeisky, cujas pesquisas anteriores mostraram que as proteínas motoras são sensíveis à presença de outras. "Na natureza, eles trabalham em equipes, mas porque os motores respondem de forma relativamente fraca a uma gama significativa de forças, argumentamos que esta é a principal razão pela qual os cinesins nem sempre cooperam uns com os outros. "
p As cinesinas transformam a energia do ATP químico, ou trifosfato de adenosina, em ação mecânica. Eles se prendem a grandes cargas como mitocôndrias ou cromossomos e os puxam ao longo dos filamentos do citoesqueleto até os confins de uma célula. Cada cinesina contém duas subunidades "principais", e cada subunidade contém dois sítios de ligação - um para agarrar e caminhar ao longo dos microtúbulos e o outro para ligar ATP.
p Os modelos mostraram cinesinas, uma família de moléculas motoras descobertas em 1985, são "fracamente suscetíveis" a forças externas pequenas ou médias e puxam sua carga por meio de oposição muito forte. Entre as forças fracas estão aquelas aplicadas por cinesinas em rastreamento presas à mesma carga.
p Acontece que esses companheiros de equipe mal se registram no kinesin chefe se estiverem a mais de 48 nanômetros de distância. Quando for esse o caso, a cinesina de chumbo carrega mais de 90 por cento da carga.
p As simulações do Rice revelaram que o líder presta mais atenção à tração da própria carga, que aciona um "interruptor" no ligador de pescoço, parte do talo que puxa a carga como uma corda em um balão. O linker acopla a carga aos locais de ligação de ATP dos motores principais, que por sua vez controla a velocidade. Uma cinesina rasteira que está muito longe não sente a força e, portanto, não pode contribuir com seu músculo.
p "Quando o motor está em movimento, o ligador de pescoço fica tenso, "disse o biofísico de Rice José Onuchic, coautor e codiretor do CTBP. "Se esse linker não for forçado, o motor perde velocidade porque não consegue tomar uma decisão sozinho. Essa competição entre a deformação e a ligação ao microtúbulo é necessária para garantir a processabilidade desse motor. "
p A simulação de base permitirá que os pesquisadores testem mais cinesinas que movem a carga do núcleo para os limites externos da célula e, eventualmente, dineins, proteínas maiores e mais complexas que movem a carga em direção ao centro.
p "Você tem que dar esse primeiro passo muito bem e com muitos detalhes para ter confiança antes de enfrentar uma fera como o dinein, "Diehl disse." Esses caras trabalharam muito duro durante anos através de vários estudos e uniram-se, coletivamente, uma maneira de enumerar e analisar as transições entre as etapas principais neste processo mecânico.
p "Agora, ser capaz de usar essa abordagem para um motor como o dineína tem a oportunidade de explicar muitas coisas importantes, mistérios fundamentais sobre como uma proteína desse complexo funciona, " ele disse.
p "É o tipo de estudo que um único investigador principal teria dificuldade em fazer, "Onuchic disse." Para problemas que são tão complicados, é bom ter essa combinação de talentos. "
