Conversão da peroxigenase P450 em peroxidase via engenharia de proteínas guiada por mecanismo
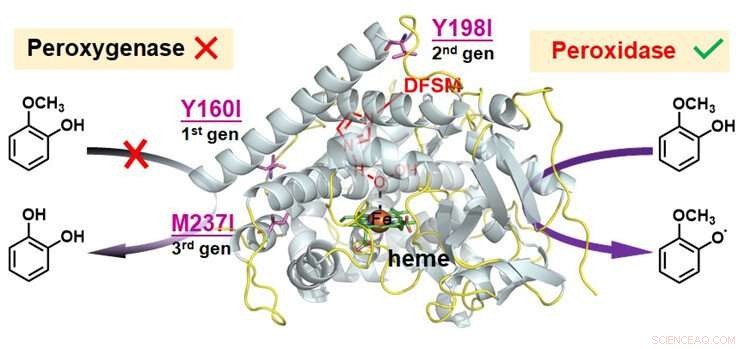 p Conversão funcional de peroxigenase em peroxidase em P450BM3-H facilitado por DFSM 2 O 2 sistema. Crédito:Ma Nana
p Conversão funcional de peroxigenase em peroxidase em P450BM3-H facilitado por DFSM 2 O 2 sistema. Crédito:Ma Nana
p A catálise enzimática é uma solução verde promissora para a produção de produtos farmacêuticos, produtos químicos finos, e biocombustíveis. Contudo, explorar sua promiscuidade catalítica para expandir e melhorar as capacidades das enzimas permanece um desafio. p Uma equipe de pesquisa liderada pelo Dr. Cong Zhiqi do Instituto Qingdao de Bioenergia e Tecnologia de Bioprocessos (QIBEBT) da Academia Chinesa de Ciências (CAS) aplicou uma estratégia de engenharia de proteínas de mutação de resíduos sensíveis a redox que permite ao sistema peroxigenase atingir peroxidase eficiente atividade.
p O estudo foi publicado em
Catálise ACS em 28 de junho.
p Em seu estudo anterior, os pesquisadores relataram um H único
2 O
2 sistema de citocromo P450 dependente, conduzido por uma pequena molécula funcional dupla (DFSM), que exibiu função peroxigenase altamente eficiente em vez de atividade peroxidase. "Contudo, a funcionalidade da peroxidase catalítica de P450s ainda não foi totalmente explorada, "disse o Dr. Cong.
p Para expandir a promiscuidade catalítica do P450-H facilitado por DFSM
2 O
2 sistema, os pesquisadores analisaram três possíveis vias catalíticas no sistema, e inferiram que a oxidação competitiva intrínseca de resíduos redox-sensíveis pode ser o principal motivo para prevenir sua função peroxidase.
p Eles identificaram pontos de acesso de resíduos sensíveis a redox, e então usou um pequeno número de aminoácidos escolhidos logicamente para trocar os resíduos nos pontos de acesso.
p Depois de combinar mutações iterativas de várias rodadas de resíduos sensíveis a redox em diferentes locais, os pesquisadores perceberam a função da peroxidase do P450-H facilitado por DFSM
2 O
2 sistema com atividade de oxidação de um elétron eficiente para vários substratos. Este sistema atingiu a melhor atividade de peroxidase de qualquer P450 relatado até o momento, e rivalizava com a maioria das peroxidases naturais.
p O estudo de simulação colaborativa com o Dr. WANG Binju da Universidade de Xiamen mostrou a possibilidade da origem da atividade da peroxidase no P450BM3-H facilitado por DFSM
2 O
2 sistema de remoção dos resíduos sensíveis a redox para eliminar suas oxidações competitivas ou a alteração da orientação do substrato após a engenharia de proteínas.
p "O estudo fornece novos insights e estratégias relevantes para expandir a promiscuidade catalítica de P450s através da combinação dos efeitos da engenharia de proteínas e moléculas exógenas, "disse o Dr. Cong.
