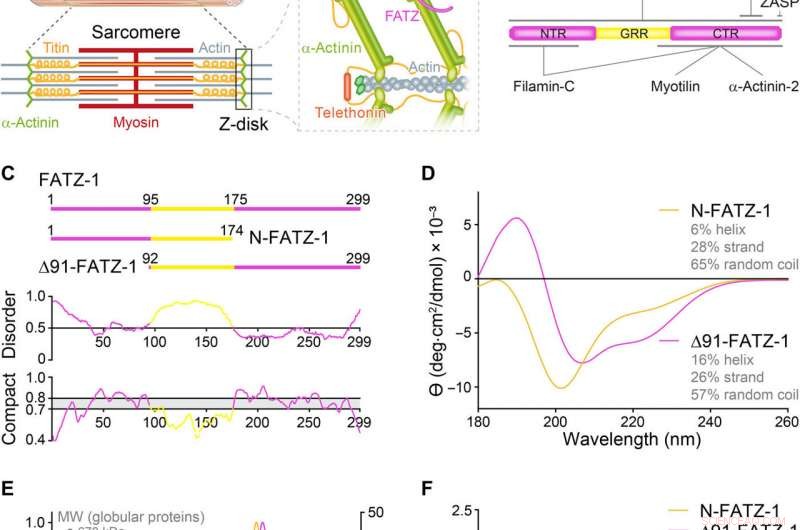
As proteínas da família FATZ apresentam distúrbio intrínseco. (A) Esquemas do sarcômero de músculo estriado e visão de perto das interações F-actina / α-actinina / FATZ no disco Z. (B) Esquemas do interactoma FATZ-1 e locais de ligação relatados até o momento. (C) Esquemas dos principais construtos FATZ-1, junto com seus limites de aminoácidos e composição de domínio. As regiões desordenadas previstas (acima de 0,5) e compactação (acima de 0,8) são mostradas abaixo. (D) Espectros de dicroísmo circular (CD) de N-FATZ-1 e Δ91-FATZ-1, junto com o conteúdo da estrutura secundária calculada. (E) Cromatografia de exclusão de tamanho (SEC) - análise de dispersão de luz multiangular (MALS) de N-FATZ-1 e Δ91-FATZ-1, produzindo pesos moleculares (MWs) de 21 e 24 kDa, respectivamente. Os volumes de eluição foram menores do que o previsto em relação aos padrões globulares [tireoglobulina (670 kDa), γ-globulina (158 kDa), ovalbumina (44 kDa), e mioglobina (17 kDa)], correspondendo a MWs de 50 e 46 kDa para N-FATZ-1 e Δ91-FATZ-1, respectivamente. UV, ultravioleta. (F) Gráficos de Kratky adimensionais de N-FATZ-1 e Δ91-FATZ-1, bem como de albumina de soro bovino globular (BSA) (código SASBDB SASDFQ8). SEC experimental - dados de espalhamento de raios-x de pequeno ângulo (SAXS) de N-FATZ-1 (G) e Δ91-FATZ-1 (I) e ajuste correspondente aos dados de conjuntos selecionados obtidos do Método de Otimização de Conjunto (EOM). As distribuições Rg de conjuntos selecionados em relação à distribuição de um conjunto aleatório são mostradas nas inserções. Representantes de modelo dos conjuntos EOM selecionados para N-FATZ-1 (H) e Δ91-FATZ-1 (J), junto com seu Rg (em nanômetros) e frações de volume (em porcentagem). Crédito:Science Advances, doi:10.1126 / sciadv.abg7653
A alfa-actinina pode reticular os filamentos de actina e ancorá-los ao disco Z nos sarcômeros. Sarcômeros são uma unidade estrutural de miofibrilas no músculo estriado. O FATZ (filamina, Proteína de ligação a α-actinina e teletonina da proteína do disco Z) pode interagir com α-actinina e outras proteínas centrais do disco Z que contribuem para a montagem e manutenção das miofibrilas. Em um novo relatório agora em Avanços da Ciência , Antonio Sponga e uma equipe de pesquisa internacional na Áustria, Alemanha, Rússia, A Polônia e o Reino Unido detalharam a primeira estrutura e validação celular do complexo α-actinina-2 com um parceiro de disco Z, FATZ-1, para formar um conjunto conforme. O FATZ-1 formou um complexo fuzzy compacto com α-actinina-2 com um mecanismo de interação proposto por meio de elementos de reconhecimento molecular e sítios de ligação secundários. O modelo integrativo obtido revelou uma arquitetura polar do complexo em combinação com a função de andaime multivalente FATZ-1 para organizar os parceiros de interação e estabilizar.
Sarcomere
Os músculos em contração podem regular o movimento animal voluntário e os batimentos cardíacos involuntários, e os sarcômeros são as unidades contráteis básicas das células musculares estriadas. Eles são compostos de matrizes de filamentos finos (actina) e grossos (miosina) que deslizam uns sobre os outros durante a contração. O disco Z pode formar a fronteira entre sarcômeros adjacentes, onde os filamentos de actina antiparalelos são ancorados. Uma estrutura de ancoragem adequadamente estável deve ser gerada pela interação entre a miosina e a actina. O disco Z pode cumprir esse papel agindo como um centro mecânico e uma plataforma de sinalização para permitir a transmissão de tensão durante a contração e a duração e transmissão de informações de estresse biomecânico. Como resultado, quaisquer mutações que perturbem a arquitetura e função do disco Z podem causar disfunção esquelética e cardíaca.
O complexo de proteínas
A alfa-actinina é uma proteína de ligação cruzada da F-actina nos discos Z musculares, que forma um componente principal do disco Z que reticula os filamentos de actina antiparalelos de sarcômeros adjacentes para servir como uma plataforma de ligação para várias proteínas do disco Z, incluindo FATZ-1. As proteínas FATZ podem se ligar a α-actinina por meio de sua região c-terminal e a domínios dos membros da família Enigma por meio de um motivo de reconhecimento c-terminal específico. Nesse trabalho, Antonio Sponga et al. demonstraram como as proteínas FATZ continham regiões intrinsecamente desordenadas (IDRs) melhor descritas como um conjunto conformacional, que são menos estáveis e carecem de uma estrutura terciária estável. Além dos métodos de caracterização biofísica, a equipe usou cristalografia de raios-X e espalhamento de raios-X de baixo ângulo para descrever um complexo α-actinina-2 / FATZ-1 "difuso". A proteína FATZ-1 pode desempenhar um papel organizacional no disco Z devido às suas propriedades de estrutura multivalente e formar um complexo compacto de arquitetura polar com α-actinina-2.
FATZ-1 forma um complexo 2:1 compacto com dímero α-actinina-2 por meio de vários locais de ligação. (A) Esquemas dos construtos de α-actinina-2, junto com seus limites de aminoácidos e composição de domínio. Análise SEC-MALS para a interação de FATZ-1, FATZ-2, e FATZ-3 com α-actinina-2 (B), N-FATZ-1 com rod-α-actinina-2 (C), Δ91-FATZ-1 com hd-α-actinina-2 (D), e cincoE Δ91-FATZ-1 mutante com α-actinina-2 (E). Análise ITC para a interação de Δ91-FATZ-1 com α-actinina-2 (F), N-FATZ-1 com rod-α-actinina-2 (G), Δ91-FATZ-1 com hd-α-actinina-2 (H), e cincoE Δ91-FATZ-1 mutante com α-actinina-2 (I). WL., não determinado. (J) razão de intensidade de sinal de 1H-15N HSQC de 15N Δ91-FATZ-1 ligado / livre, mapeamento do sítio de ligação primária de FATZ-1 para α-actinina-2. A parte não atribuída em FATZ-1 está em uma caixa, e os resíduos são plotados em uma posição aleatória. (K) Sequência de FATZ-1 mostrando múltiplos locais de interação para α-actinina-2 conforme determinado a partir da matriz de peptídeos (resíduos quadrados), XL-MS (estrela), LP-MS (resíduos delimitados por setas), e NMR (setas). Os resíduos que correspondem ao péptido de sinal mais forte na matriz de péptidos são apresentados a negrito. Os limites para Δ91-FATZ-1 e mini-FATZ-1 são delimitados por setas. Mutações dentro de cincoE Δ91-FATZ-1 e RRE Δ91-FATZ-1 são indicadas em laranja e ciano escuro, respectivamente. Crédito:Science Advances, doi:10.1126 / sciadv.abg7653 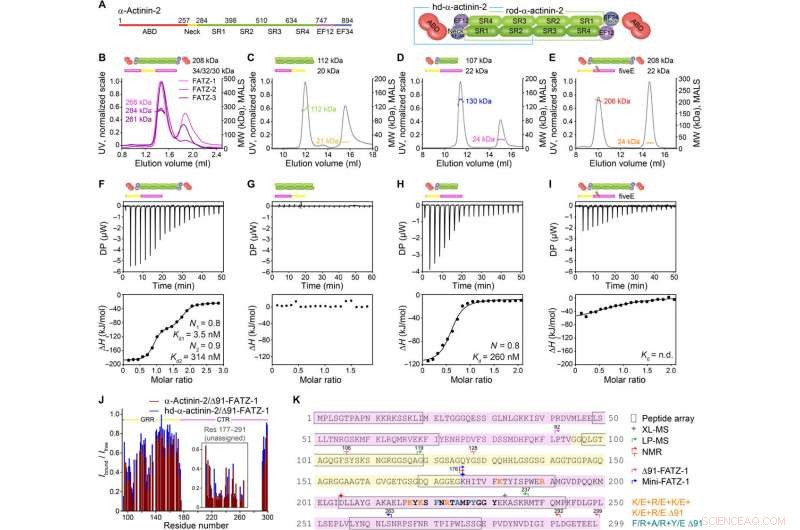
A família de proteínas FATZ é encontrada em todos os vertebrados onde FATZ-1 humano, FATZ-2, e FATZ-3 compartilham 34 a 40 por cento da identidade de sequência. Os cientistas reconheceram fragmentos resistentes à proteólise, após a realização de experimentos de proteólise. Quando eles combinaram cromatografia de exclusão de tamanho (SEC) com dispersão de luz multiangular, eles notaram os monômeros predominantes sob condições experimentais. Eles então caracterizaram ainda mais os monômeros usando SEC combinado com espalhamento de raios-X de pequeno ângulo e também destacaram a natureza intrinsecamente desordenada / estado de conjunto dos monômeros usando espectros de coerência quântica única (HSQC), para ambas as construções. Para entender a estequiometria de ligação das proteínas FATZ-1 a 3 para α-actinina-2, Sponga et al. usou cromatografia de exclusão de tamanho - espalhamento de luz multiangular (SEC-MALS). Para caracterizar a estequiometria de ligação das proteínas FATZ-1 a 3 para α-actinina-2, Sponga et al. usado SEC-MALS. O resultado mostrou como cada uma das três proteínas FATZ formou um complexo compacto com α-actinina-2, com uma estequiometria de ligação de duas moléculas FATZ por dímero de α-actinina-2. Essa é uma molécula FATZ por subunidade α-actinina-2. Em seguida, a equipe usou calorimetria de titulação isotérmica (ITC) para quantificar a afinidade de interação.
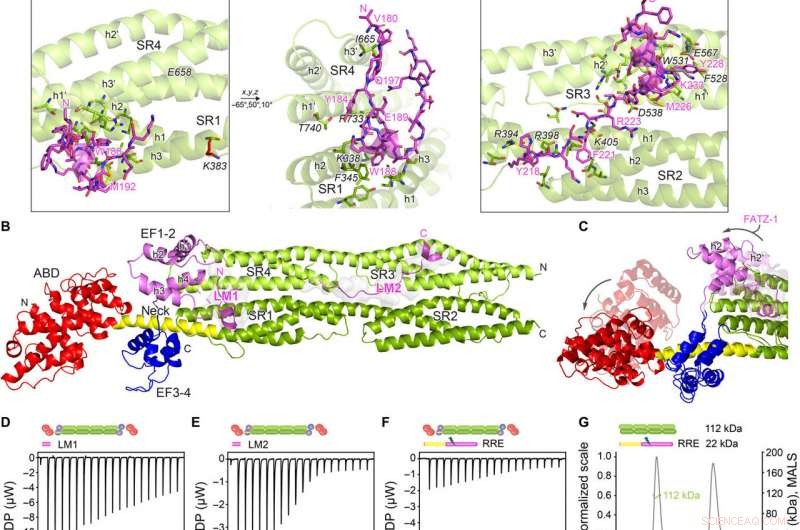
Estruturas de cristal de α-actinina-2 / FATZ-1 revelam dois motivos de ligação linear em FATZ-1. (A) Estrutura cristalina da haste-α-actinina-2 / mini-FATZ-1 (em verde / magenta), juntamente com a sequência de consenso FATZ-1 determinada (35 a 80% e 60 a 84% de identidade de sequência em pares para LM1 e LM2, respectivamente). Os resíduos reticulados são indicados por azul, vermelho, e estrelas / bolas / paus cinza na sequência / estrutura. Se-Mets identificados são mostrados em amarelo. O dímero da haste-α-actinina-2 é montado através de um eixo duplo cristalográfico entre pares de simetria (círculo preto). Resíduos de interação (rod-α-actinina-2 em itálico), junto com hélices de SR1 / SR2 (h1, h2, e h3) e SR3 / SR4 (h1 ′, h2 ′, e h3 ′), são mostrados em visualizações de perto. (B) Estrutura de cristal de hd-α-actinina-2 / Δ91-FATZ-1 (LM1 e LM2 como desenho magenta e superfície cinza transparente; hd-α-actinina-2 codificado por cores como na Fig. 2A). (C) Comparação de [Protein Data Bank (PDB) código 4D1E] não ligado e ligado (este trabalho) hd-α-actinina-2. ABD e EF1-2 de hd-α-actinina-2 não ligado são mostrados com transparência. Análise ITC para a interação do peptídeo LM1 com α-actinina-2 (D), Peptídeo LM2 com α-actinina-2 (E), e RRE Δ91-FATZ-1 mutante com α-actinina-2 (F). Análise SEC-MALS para a interação de RRE Δ91-FATZ-1 mutante com rod-α-actinina-2 (G) e Δ91-FATZ-1 com E. histolytica rod-α-actinina-2 (H). Crédito:Science Advances, doi:10.1126 / sciadv.abg7653
Múltiplos sítios de ligação para o complexo de proteínas
A equipe observou como FATZ-1 interagiu com α-actinina-2 por meio de vários locais de ligação. Para restringir os locais de ligação FATZ-1, Sponga et al. usaram proteólise limitada e reticulação química juntamente com espectrometria de massa no complexo proteico. Para, então, auxiliar na cristalização deste complexo de proteínas, a equipe também combinou as informações da matriz de peptídeos e gerou uma construção mais curta conhecida como mini-FATZ-1 para estudos adicionais sobre sua biologia estrutural. Os cientistas então validaram os modelos difusos desenvolvidos no trabalho usando a viscosidade intrínseca calculada e experimentalmente derivada - um parâmetro hidrodinâmico da conformação da proteína. Para então entender a contribuição de α-actinina-2 para localizar proteínas FATZ no disco Z do sarcômero, Sponga et al. transfectadas proteínas FATZ-1 ou FATZ-2 marcadas com GFP em mioblastos de camundongo imortalizados ou cardiomiócitos de rato neonatal. Ambas as proteínas FATZ-1 e -2 foram corretamente direcionadas ao disco Z e co-localizadas com α-actinina-2.
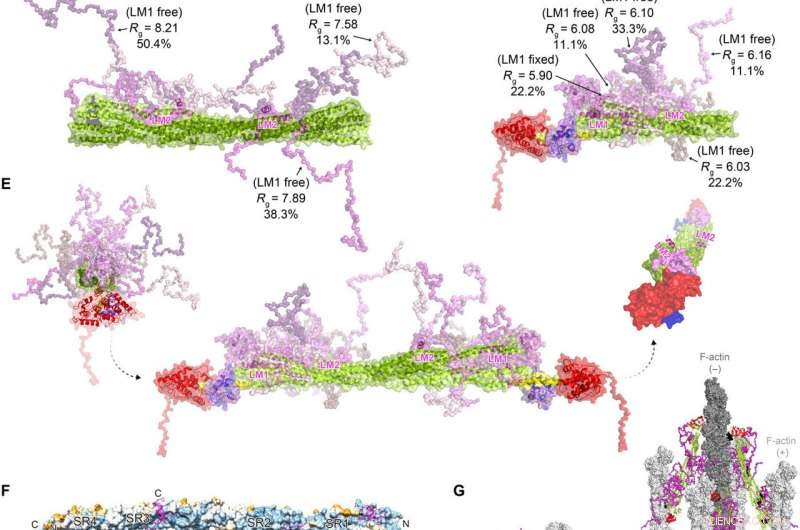
FATZ-1 forma um complexo difuso com α-actinina-2 resultando em uma arquitetura polar do complexo. Dados experimentais de SAXS de rod-α-actinina-2 / Δ91-FATZ-1 (A) e hd-α-actinina-2 / Δ91-FATZ-1 (B), com o modelo correspondente ajusta-se aos dados dos conjuntos selecionados. GAJOE, Otimização de Julgamento de Algoritmo Genético de Conjuntos. Regiões flexíveis de Δ91-FATZ-1, invisível em nossas estruturas cristalinas determinadas, foram gerados com EOM mantendo LM1 fixo ou livre (10, 000 modelos para cada). Representantes do modelo de conjunto selecionado para rod-α-actinina-2 / Δ91-FATZ-1 (C) e hd-α-actinina-2 / Δ91-FATZ-1 (D), junto com seu Rg e frações de volume dentro do conjunto. (E) Modelo integrativo de fuzzy α-actinina-2 / Δ91-FATZ-1 construído usando cristalografia de raios-X e modelos SAXS de hd-α-actinina-2 / Δ91-FATZ-1. Rotação para hélices LM2 de moléculas FATZ-1 ligadas entre si, bem como torção torcional na haste ao longo do eixo longitudinal α-actinina-2, é mostrado na inserção direita (partes flexíveis FATZ-1 são omitidas para maior clareza). (F) Superfície da estrutura da haste-α-actinina-2 / FATZ-1 mostrando a conservação da sequência de resíduos que interagem com α-actinina para FATZ-1 (alinhamento feito usando 1505 α-actininas de vertebrados). (G) Modelo de F-actina / α-actinina-2 / FATZ-1 (F-actina em cinza claro e escuro) com base em uma estrutura de tomografia crio-elétron do disco Z e o modelo integrativo. Crédito:Science Advances, doi:10.1126 / sciadv.abg7653
Panorama
Desta maneira, Antonio Sponga e colegas descreveram como a montagem do sarcômero começou a partir de corpos Z de α-actinina-2, para incluir proteínas como FATZ, miotilina, e actina, para nomear alguns. O resultado indica que as proteínas da família FATZ estão disponíveis em corpos Z e discos Z maduros com um papel nas vias de sinalização de proteínas para ligar a calcineurina. A equipe destacou o papel do FATZ-1, o membro da família mais estudado e sua interação com a principal proteína do disco Z α-actinina-2. A estrutura e o mecanismo de ligação do complexo fuzzy α-actinina-2 / FATZ-1 suportou a função FATZ-1 como uma proteína de andaime clássica na montagem do Z-disk. Novos estudos irão revelar se os mesmos princípios se aplicam em condições fisiológicas em células vivas.
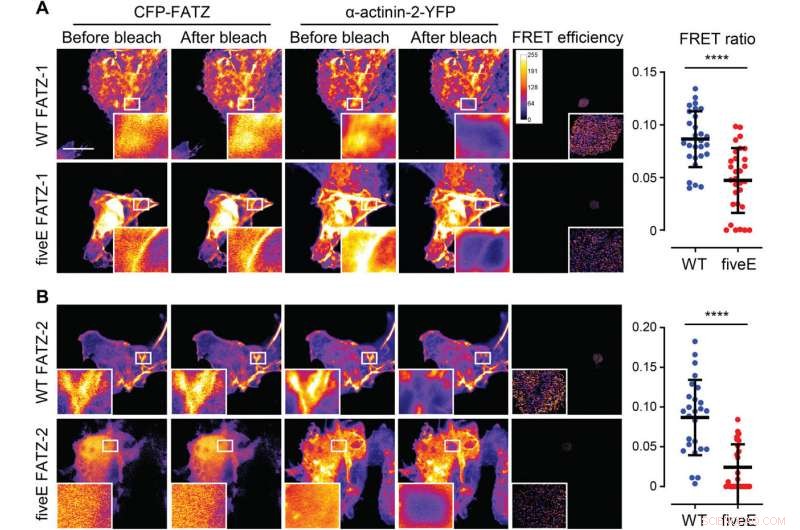
A α-Actinina-2 estabiliza as proteínas FATZ no disco Z. (A) Células COS-1 que coexpressam CFP aprimorado (ECFP) - marcado com FATZ-1 (WT FATZ-1) ou mutante fiveE correspondente, em combinação com actinina-2-EYFP, como determinado em células fixas por fotobranqueamento aceptor. Imagens representativas são mostradas antes e depois do branqueamento para ambas as proteínas. As regiões branqueadas de interesse são mostradas (inserções), junto com as eficiências FRET usadas para calcular as razões FRET apresentadas no gráfico adjacente [n =28 (WT) e 30 (cincoE), **** P <0,0005, Teste t de Student). (B) Mesmas células que em (A), mas coexpressando variantes FATZ-2 marcadas com ECFP em combinação com EYFP-α-actinina-2 [n =26 (WT) e 25 (cincoE), **** P <0,0005, Teste t de Student). Barras de escala, 10 μm em todas as imagens. Crédito:Science Advances, doi:10.1126 / sciadv.abg7653
© 2021 Science X Network