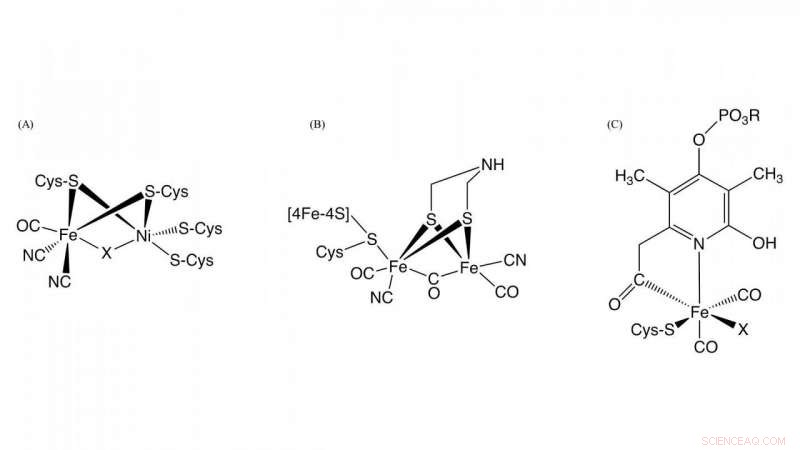
Figura 1. Estrutura dos sítios ativos em [NiFe] -hidrogenase, [FeFe] -hidrogenase, e [Fe] -hidrogenase Crédito:NINS / IMS
Um grupo de pesquisa incluindo pesquisadores do Centro de Pesquisa Exploratória em Sistemas Vivos e de Vida (ExCELLS), Institute for Molecular Science (IMS) no National Institutes of Natural Sciences, e a Universidade de Osaka revelaram o mecanismo detalhado da biossíntese de monóxido de carbono essencial para a maturação do sítio ativo da NiFe-hidrogenase.
Hidrogenase, que é uma metaloenzima responsável pela oxidação do gás hidrogênio e a redução dos prótons, desempenha um papel fundamental no metabolismo do hidrogênio bacteriano. Com base nas diferenças de conteúdo de metal no site ativo, eles são classificados em três grupos:NiFe-, FeFe-, e Fe-hidrogenases contendo diferentes complexos metálicos como centros ativos nessas enzimas (Figura 1). Embora as estruturas nos centros ativos deles sejam diferentes, é essencial para a atividade da hidrogenase que o monóxido de carbono (CO) seja coordenado com o íon ferro no centro ativo. Sabe-se que o CO é biossintetizado por uma reação enzimática, mas o detalhe da biossíntese de CO era desconhecido.
Nesta pesquisa, o grupo determinou a estrutura cristalina da enzima (HypX) responsável pela biossíntese de CO (Figura 2), com base no qual HypX biossintetiza CO por uma reação sem precedentes para a maturação de NiFe-hidrogenase. HypX consiste em dois domínios:os domínios N-terminal e C-terminal. Uma cavidade contínua conectando os domínios dos terminais N e C está presente no interior do HypX (Figura 2). Na estrutura cristalina, a coenzima A (CoA) está ligada à região C-terminal da cavidade.
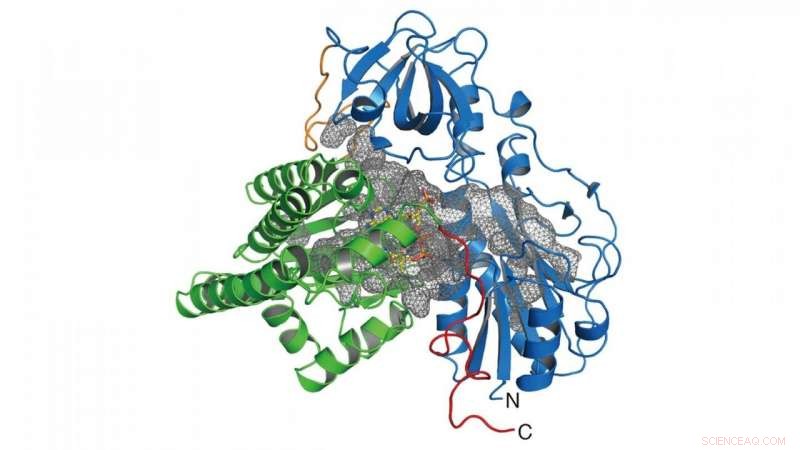
Figura 2. Estrutura de cristal de HypX. Os domínios N- e C-terminais são mostrados em azul e verde, respectivamente. A cavidade dentro do HypX é mostrada em uma malha cinza. Crédito:NINS / IMS
Duas reações diferentes ocorrem nos domínios N- e C-terminais. No domínio N-terminal, uma reação de transferência de grupo formil a partir de formiltetrahidrofolato, que é ligado na região N-terminal da cavidade como um substrato para CoA, ocorre (etapa de reação 1 na Fig. 3). Neste momento, CoA na cavidade adota a conformação linear estendida, e o grupo SH de CoA está localizado próximo ao grupo formil no formiltetra-hidrofolato ligado ao domínio N-terminal. Então, formil-CoA é produzido como um intermediário de reação pela reação de transferência do grupo formil de formiltetra-hidrofolato para CoA.
Na próxima etapa, formil-CoA sofre uma grande mudança conformacional na cavidade de modo que o grupo formil na posição terminal de formil-CoA está localizado no sítio ativo no domínio C-terminal de HypX (etapa de reação 2 na Fig. 3). No domínio C-terminal, CO é formado por descarbonilação de formil-CoA (etapa de reação 3 na Fig. 3).
Esta reação de biossíntese de CO é uma reação nova e sem precedentes. CoA é bem conhecido como uma coenzima, que tem papel importante no metabolismo dos ácidos graxos e no metabolismo energético celular através do ciclo do ácido cítrico. Contudo, nunca foi relatado que CoA / formil-CoA está envolvido em reações de biossíntese de CO. Esta pesquisa revelou uma nova função fisiológica de uma coenzima CoA bem conhecida.
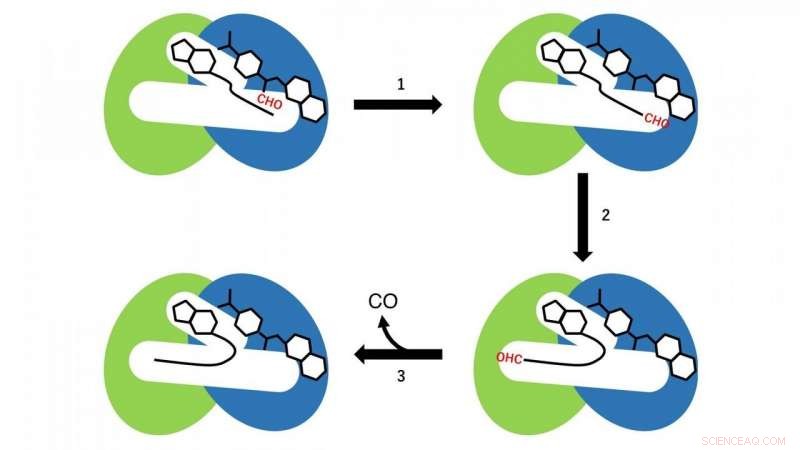
Figura 3. Esquema de reação da biossíntese de CO por HypX. Os domínios do terminal N e C são mostrados em azul e verde, respectivamente. O grupo formil (CHO) é mostrado em vermelho. Crédito:NINS / IMS
Perspectivas futuras:
Os mecanismos biossintéticos das metaloenzimas permanecem desconhecidos em muitos casos. Resta ser elucidado especialmente como os centros ativos contendo metal das metaloenzimas foram montados. Nesse trabalho, determinamos a primeira estrutura cristalina da enzima que catalisa a reação biossintética do monóxido de carbono essencial para a construção do sítio ativo da [NiFe] hidrogenase. No futuro, continuaremos a pesquisa para elucidar o mecanismo detalhado de toda a via de maturação da hidrogenase com base neste resultado.