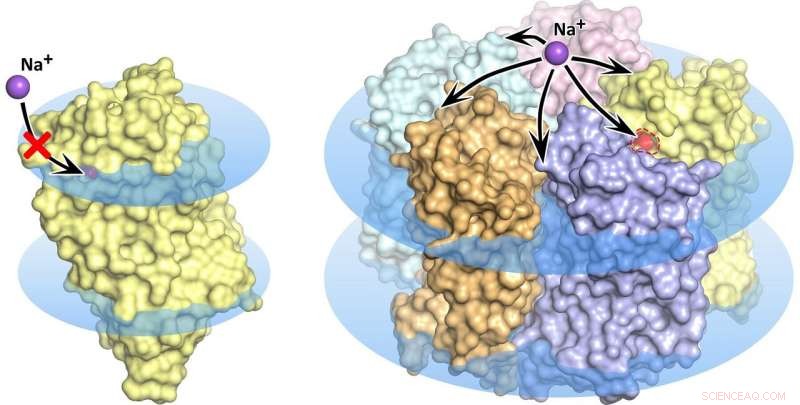
Monômero de rodopsina KR2 (esquerda) e pentâmero (direita) na membrana celular, mostrado como discos azuis. No estado monomérico, o transporte de sódio está bloqueado, o poro laranja não permite a absorção de íons pela proteína. Crédito:Kirill Kovalev et al./ Avanços da Ciência
Uma equipe de biofísicos da Rússia, Alemanha, e França, apresentando pesquisadores do Instituto de Física e Tecnologia de Moscou, descobriu e estudou a estrutura da rodopsina KR2 em condições fisiológicas. Este trabalho pioneiro abre caminho para um avanço futuro em optogenética, uma área altamente relevante da biomedicina com aplicações no tratamento de doenças neurológicas e muito mais. A descoberta fundamental levará a um novo instrumento para a terapia eficiente da depressão, transtornos de ansiedade, epilepsia, e doença de Parkinson. O artigo relatando o estudo foi publicado em Avanços da Ciência .
A optogenética é uma área inteiramente nova da biofísica e técnicas de exploração da biomedicina para controlar as células nervosas e musculares em um organismo vivo por meio de sinais de luz. Não faz muito tempo, o jornal de pesquisa líder Ciência saudou a optogenética como o "avanço da década". Os métodos optogenéticos já permitem uma recuperação parcial da visão perdida, audição, e controle muscular prejudicado por uma doença neurológica. Mais importante, essas técnicas permitem que os pesquisadores estudem as redes neurais em detalhes. Isso se refere não a redes de computadores, mas àquelas alojadas no cérebro humano e responsáveis por nossas emoções, tomando uma decisão, e outros processos fundamentais.
Vários anos atrás, os pesquisadores descobriram um novo tipo de transportador de íons - a rodopsina KR2 - na membrana celular da bactéria marinha Krokinobacter eikastus. A proteína recém-descoberta é sensível à luz, tornando-o útil para optogenética. Impulsionado pela luz, tais proteínas podem facilitar a translocação de partículas carregadas, como íons, através da membrana celular. Ao introduzir esses transportadores na célula, os pesquisadores podem então usar pulsos de luz para manipular o potencial da membrana celular do neurônio, controlando sua atividade. Foi demonstrado que o KR2 transporta seletivamente um tipo particular de partículas - íons de sódio - para fora da célula. Em vez de permitir a passagem desses íons em ambas as direções, a proteína realiza transporte ativo, servindo como uma "bomba". As formas mutantes de KR2 também mostraram atividade de bombeamento de potássio. Ao implantar essas bombas na membrana celular, todo o escopo da atividade neuronal poderia teoricamente ser controlado.
A onda de pesquisas que se seguiu à descoberta da nova bomba molecular enfrentou algumas propriedades bem misteriosas da rodopsina. Vários grupos de pesquisa descobriram e descreveram um total de cinco estruturas diferentes da proteína promissora. Notavelmente, em algumas dessas estruturas cinco moléculas KR2 formam um pentâmero estável, enquanto em outros, apenas o monômero de proteína está presente (figura 1).
"Portanto, a pergunta dramática era:Qual dessas estruturas deveria ser considerada a certa?" disse o estudante de doutorado do MIPT Kirill Kovalev, um dos principais autores do estudo. "Na verdade, as estruturas acabaram sendo muito semelhantes, mas o diabo está nos detalhes, que determinam as possíveis aplicações da proteína na ciência e na prática clínica. "
Liderado por biofísicos do MIPT, a equipe descobriu o que dá origem à variedade confusa de estruturas de proteínas. Descobriu-se que os grupos de pesquisa que estudavam o KR2 haviam cristalizado a proteína em diferentes condições. A proteína única é originalmente produzida por uma bactéria oceânica nativa de um ambiente muito especial. Ele vive na água com uma salinidade específica, acidez, e concentração de íon hidrogênio (pH). Essas condições são um pré-requisito para que a proteína faça o que os pesquisadores esperam que ela faça, ou seja, bombear íons de sódio, enquanto também forma pentâmeros na membrana celular. As numerosas estruturas "falsas" da proteína revelaram-se ou artefatos de cristalização ou apenas correspondem às condições que virtualmente desativam a atividade de bombeamento de sódio do KR2, o que o torna altamente atraente para a comunidade optogenética global.
"Pela primeira vez, simulamos as condições fisiológicas para a existência e funcionamento do KR2. Como resultado, obtivemos a estrutura "correta" da nova proteína, que corresponde ao seu estado nativo. Mostramos que a unidade funcional da proteína é um pentâmero, "explicou Valentin Gordeliy, do Instituto de Biologia Estrutural de Grenoble." Além disso, encontramos uma explicação para as contradições entre os estudos estruturais anteriores da proteína. "
A rodopsina KR2 é revolucionária para optogenética, e conhecer sua correta estrutura em condições fisiológicas é fundamental tanto para compreender os mecanismos de seu funcionamento quanto para explorar o sistema nervoso, modelando novas ferramentas optogenéticas e aplicando-as na prática médica.