 p Tendências da tabela periódica. Crédito:Sandbh / Wikipedia, CC BY-SA
p Tendências da tabela periódica. Crédito:Sandbh / Wikipedia, CC BY-SA
p A notícia de que um vagão de trem, carregado com sódio puro, tinha acabado de descarrilar e estava derramando seu conteúdo. Um repórter de televisão me ligou para uma explicação de por que os bombeiros não tinham permissão para usar água nas chamas que saíam do carro destroçado. Enquanto estava no ar, adicionei um pouco de sódio a um pouco de água em uma placa de Petri e observamos a reação violenta. Para um efeito dramático adicional, Também coloquei um pouco de potássio na água e surpreendi a todos com as explosivas chamas azuladas. p Porque os metais do Grupo I, também conhecido como metais alcalinos, são muito reativos, como o sódio do vagão ou o potássio, eles não são encontrados na natureza na forma pura, mas apenas como sais. Eles não são apenas muito reativos, eles são macios e brilhantes, podem ser facilmente cortados mesmo com uma faca cega e são os mais metálicos de todos os elementos conhecidos.
p Eu sou um químico que passou sua carreira construindo novas moléculas, às vezes usando elementos do Grupo I. Ao estudar o comportamento e as tendências dos elementos do Grupo I, podemos ter um vislumbre de como a tabela periódica está organizada e como interpretá-la.
p
O básico
p O arranjo da tabela periódica e as propriedades de cada elemento é baseado no número atômico e no arranjo dos elétrons que orbitam o núcleo. O número atômico descreve o número de prótons no núcleo do elemento. O número atômico do hidrogênio é 1, hélio é 2, o do lítio é 3 e assim por diante.
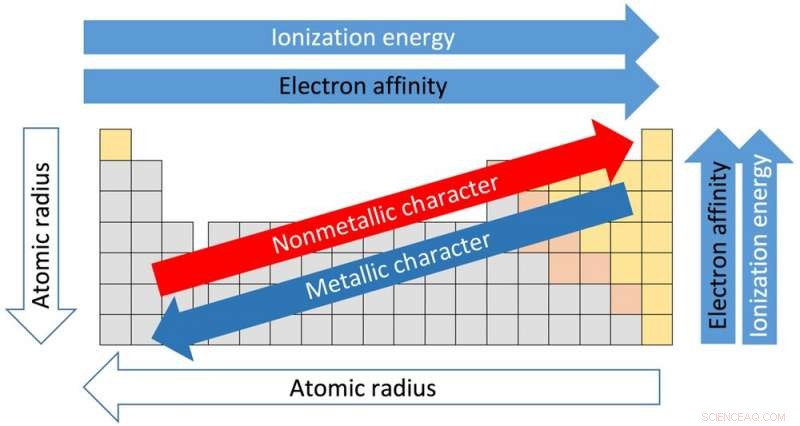
p Cada uma das 18 colunas da tabela é chamada de grupo ou família. Os elementos no mesmo grupo compartilham propriedades semelhantes. E as propriedades podem ser assumidas com base na localização dentro do grupo. Indo da parte superior do Grupo I para a parte inferior, por exemplo, os raios atômicos - a distância do núcleo aos elétrons externos - aumentam. Mas a quantidade de energia necessária para arrancar um elétron externo diminui indo de cima para baixo porque os elétrons estão mais distantes do núcleo e não são mantidos com tanta força.
p Isso é importante porque como os elementos interagem e reagem uns com os outros depende de sua capacidade de perder e ganhar elétrons para fazer novos compostos.
p As linhas horizontais da tabela são chamadas de períodos. Movendo-se do lado esquerdo do período para a direita, o raio atômico torna-se menor porque cada elemento tem um próton adicional e um elétron adicional. Mais prótons significa que os elétrons são puxados com mais força em direção ao núcleo. Pela mesma razão, a eletronegatividade - o grau em que um elemento tende a ganhar elétrons - aumenta da esquerda para a direita.
p A força necessária para remover o elétron mais externo, conhecido como potencial de ionização, também aumenta do lado esquerdo da mesa, que possui elementos com caráter metálico, para o lado direito, que não são metais.
p A eletronegatividade diminui da parte superior da coluna para a parte inferior. O ponto de fusão dos elementos dentro de um grupo também diminui do topo para a base de um grupo.
p
Aplicando o básico aos elementos do Grupo I
p Como o próprio nome indica, Os elementos do grupo I ocupam a primeira coluna da tabela periódica. Cada elemento inicia um novo período. O lítio está no topo do grupo e é seguido pelo sódio, N / D; potássio, K; rubídio, Rb; césio, Cs e termina com o frâncio radioativo, Fr. Por ser altamente radioativo, virtualmente nenhuma química é realizada com este elemento.
p Como cada elemento nesta coluna tem um único elétron externo em uma nova camada, os volumes desses elementos são grandes e aumentam drasticamente ao passar do topo para a base do grupo.
p De todos os elementos do Grupo I, o césio tem os maiores volumes porque o único elétron externo é frouxamente retido.
p Apesar dessas tendências, as propriedades dos elementos do Grupo I são mais semelhantes entre si do que as de qualquer outro grupo.
p
Metais alcalinos ao longo da história
p Usando propriedades químicas como guia, O químico russo Dimitri Mendeleev ordenou corretamente os primeiros elementos do Grupo I em sua tabela periódica de 1869. É chamado de periódico porque cada oitavo elemento repete as propriedades daquele que está acima dele na tabela. Depois de organizar todos os elementos então conhecidos, Mendeleev deu o passo ousado de deixar espaços em branco onde sua extrapolação das propriedades químicas mostrou que um elemento deveria existir. A descoberta subsequente desses novos elementos provou que sua previsão estava correta.
p Alguns metais alcalinos são conhecidos e bem utilizados muito antes de Mendeleev criar a tabela periódica. Por exemplo, o Antigo Testamento menciona o sal - uma combinação do sódio de metal alcalino com o cloro - 31 vezes. O Novo Testamento se refere a ele 10 vezes e chama o carbonato de sódio de "neter" e o nitrato de potássio de "salitre".
p As pessoas sabem desde a antiguidade que as cinzas da madeira produzem um sal de potássio que, quando combinado com gordura animal, vai produzir sabão. Samuel Hopkins obteve a primeira patente nos EUA em 31 de julho, 1790, para sabonetes sob o novo estatuto de patente que acabou de ser sancionado pelo presidente George Washington alguns meses antes.
p A indústria pirotécnica adora esses elementos do Grupo I por suas cores vibrantes e natureza explosiva. A queima de lítio produz uma cor vermelha carmesim vívida; sódio um amarelo; potássio lilás; vermelho rubídio; e violeta de césio. Essas cores são produzidas quando os elétrons saltam de seu ambiente doméstico orbitando o núcleo e retornando novamente.
p O relógio atômico de césio, o relógio mais preciso já desenvolvido, funções medindo a frequência dos elétrons de césio saltando para frente e para trás entre os estados de energia. Os relógios baseados em saltos de elétrons fornecem uma maneira extremamente precisa de contar os segundos.
p Outras aplicações incluem lâmpadas de vapor de sódio e baterias de lítio.
p Em minha própria pesquisa, usei metais do Grupo I como ferramentas para realizar outras químicas. Uma vez que eu estava precisando de álcool absolutamente seco, e o mais seco que consegui comprar ainda continha vestígios de água. A única maneira de se livrar do último resíduo de água era tratando o álcool que continha a água com sódio - uma maneira bastante dramática de remover a água.
p Os elementos alcalinos não ocupam apenas a primeira coluna da tabela periódica, mas eles também mostram a maior reatividade de todos os grupos em toda a tabela e têm as tendências mais dramáticas em volume e potencial de ionização, mantendo grande semelhança entre si. p Este artigo foi republicado de The Conversation sob uma licença Creative Commons. Leia o artigo original.


