Dores menstruais. Crédito:European Chemical Society
É incrível pensar que tudo ao nosso redor é feito de apenas 90 blocos de construção - os elementos químicos que ocorrem naturalmente. Dmitri Mendeleev ordenou as 63 conhecidas na época e publicou sua primeira versão do que agora reconhecemos como a tabela periódica em 1869. Naquele ano, a guerra civil americana acabara de terminar, Alemanha estava prestes a ser unificada, Tolstói publicou Guerra e Paz, e o Canal de Suez foi aberto.
Existem agora 118 elementos conhecidos, mas apenas 90 que ocorrem na natureza. O resto são principalmente substâncias superpesadas que foram criadas em laboratórios nas últimas décadas por meio de reações nucleares, e decair rapidamente em um ou mais dos elementos naturais.
A posição de cada um desses elementos naturais na tabela periódica nos permite saber imediatamente muito sobre como ele se comportará. Para comemorar o 150º aniversário deste recurso incrível, A UNESCO proclamou 2019 como o Ano Internacional da Tabela Periódica.
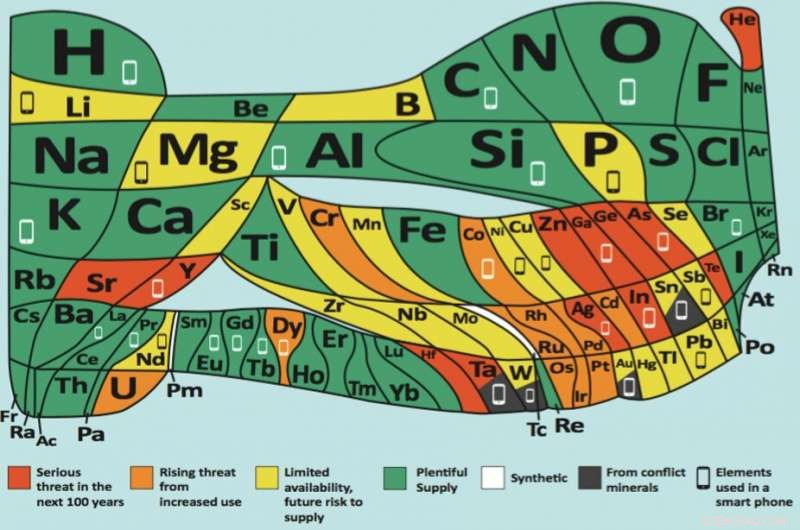
Como parte das comemorações, a European Chemical Society publicou uma versão completamente nova da tabela periódica - veja a imagem principal. Ele foi projetado para transmitir uma mensagem atraente sobre o desenvolvimento sustentável; baseado em uma ideia original na década de 1970 do químico americano William Sheehan, a tabela foi completamente redesenhada para que a área ocupada por cada elemento represente sua abundância em uma escala logarítmica.
Vermelho para perigo
Cada área da nova tabela foi codificada por cores para indicar sua vulnerabilidade. Na maioria dos casos, elementos não estão perdidos, mas, como os usamos, eles se dissipam e são muito menos fáceis de recuperar. O vermelho indica que a dissipação tornará os elementos muito menos disponíveis em 100 anos ou menos - isso é o hélio (He), prata (Ag), telúrio (Te), gálio (Ga), germânio (Ge), estrôncio (Sr), ítrio (Y), zinco (Zn), índio (In), arsênico (As), háfnio (Hf) e tântalo (Ta).
Para dar apenas alguns exemplos, o hélio é usado para resfriar os ímãs em scanners de ressonância magnética e para diluir o oxigênio para mergulho em alto mar. Os bastonetes vitais em reatores nucleares usam háfnio. Sais de estrôncio são adicionados a fogos de artifício e foguetes para produzir cores vermelhas vivas. O ítrio é um componente das lentes das câmeras para torná-las resistentes a choques e ao calor. Também é usado em lasers e ligas. Gálio, Enquanto isso, é usado para fazer espelhos de alta qualidade, diodos emissores de luz e células solares.
Enquanto isso, as áreas laranja e amarela na nova tabela periódica antecipam problemas causados pelo aumento do uso desses elementos, também. Verde significa que a abundância está disponível - incluindo os gostos de oxigênio (O), hidrogênio (H), alumínio (Al) e cálcio (Ca).

De estrôncio com amor. Crédito:Gary L Jones
Quatro elementos - estanho (Sn), tântalo (Ta) tungstênio (W) e ouro (Au) - são coloridos de preto porque geralmente vêm de minerais de conflito; isso é, de minas onde guerras são travadas por sua propriedade. Todos eles podem ter fontes mais éticas, portanto, tem a intenção de lembrar que os fabricantes devem rastrear cuidadosamente sua origem para ter certeza de que as pessoas não morreram para fornecer os minerais em questão.
Escassez de smartphones
Dos 90 elementos, 31 carregam um símbolo de smartphone - refletindo o fato de que todos eles estão contidos nesses dispositivos. Isso inclui todos os quatro elementos de minerais de conflito e outros seis com vidas úteis projetadas de menos de 100 anos.
Vamos considerar o índio (In), por exemplo, que é colorido de vermelho na mesa. Cada tela sensível ao toque contém uma camada condutora transparente de óxido de índio e estanho. Existe uma grande quantidade de índio, mas já está altamente disperso. É um subproduto da fabricação de zinco, mas há apenas o suficiente dessa fonte para cerca de 20 anos. Então, o preço começará a subir rapidamente - a menos que façamos algo para preservar os estoques atuais.
As três possibilidades principais são:substituir, reciclar ou usar menos. Enormes esforços estão sendo feitos para encontrar materiais alternativos baseados em elementos abundantes na Terra. Recuperar índio de telas usadas é possível e está sendo tentado. Mas quando olhamos para a Tabela Periódica e a natureza muito preciosa de muitos dos elementos, podemos justificar a troca de telefone a cada dois anos ou mais?
Atualmente, mais de 1 milhão de telefones são negociados a cada mês apenas no Reino Unido (10 milhões na Europa, 12m nos EUA). Quando trocamos nossos smartphones, muitos deles vão inicialmente para o mundo em desenvolvimento para reutilização. A maioria acaba em aterros sanitários ou são feitas tentativas para extrair alguns dos elementos em condições terríveis. Os outros elementos permanecem nas bebidas ácidas. Esse, e os muitos que estão em gavetas, é como os elementos nos telefones celulares se dissipam.
O número de telefones que comercializamos pode ser bastante reduzido e, com isso, a demanda por recursos limitados, como o índio. Nesse contexto, o recente aviso de lucro da Apple, em parte devido aos clientes substituindo seus iPhones com um pouco menos de frequência, foi pelo menos um sinal de melhora.
Mas, como sublinha a nova versão da tabela periódica, devemos fazer tudo o que estiver ao nosso alcance para conservar e reciclar os 90 preciosos blocos de construção que compõem nosso mundo maravilhosamente diversificado. Se não começarmos a levar esses problemas mais a sério, muitos dos objetos e tecnologias que agora consideramos naturais podem ser relíquias de uma era mais abundante, daqui a algumas gerações - ou disponíveis apenas para pessoas mais ricas.
Este artigo foi republicado de The Conversation sob uma licença Creative Commons. Leia o artigo original. 