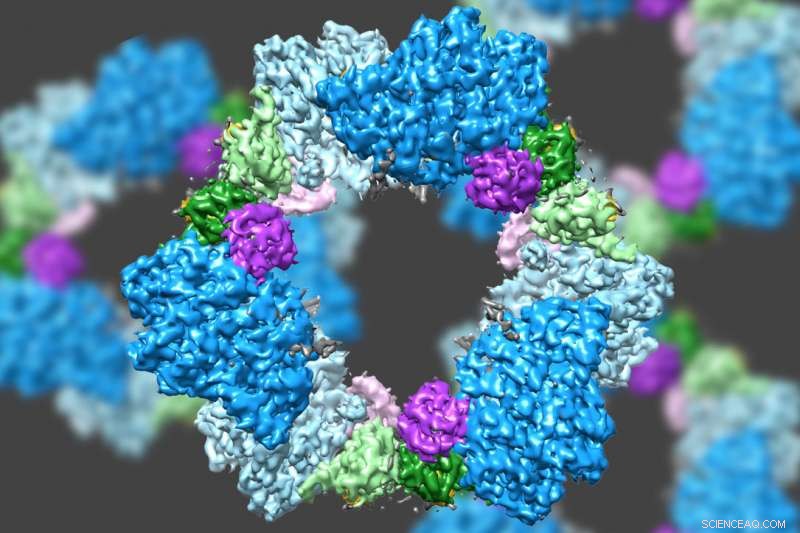
Usando um tipo de microscopia eletrônica de última geração, uma equipe liderada pelo MIT descobriu a estrutura de uma enzima que é crucial para manter um suprimento adequado de blocos de construção de DNA em células humanas. Crédito:Massachusetts Institute of Technology
Usando um tipo de microscopia eletrônica de última geração, uma equipe liderada pelo MIT descobriu a estrutura de uma enzima que é crucial para manter um suprimento adequado de blocos de construção de DNA em células humanas.
Sua nova estrutura também revela o provável mecanismo de como as células regulam a enzima, conhecido como ribonucleotídeo redutase (RNR). Significativamente, o mecanismo parece ser diferente daquele da versão bacteriana da enzima, sugerindo que seria possível desenvolver antibióticos que bloqueiem seletivamente a enzima bacteriana.
"As pessoas têm tentado descobrir se há algo diferente o suficiente para que você possa inibir as enzimas bacterianas e não a versão humana, "diz Catherine Drennan, professor de química e biologia do MIT e investigador do Howard Hughes Medical Institute. "Ao considerar essas enzimas-chave e descobrir quais são as diferenças e semelhanças, podemos ver se há algo na enzima bacteriana que poderia ser direcionada com drogas de moléculas pequenas. "
Drennan é um dos autores seniores do estudo, que aparece na edição de 20 de fevereiro da revista eLife . JoAnne Stubbe, o Professor Emerita de Química da Novartis no MIT, e Francisco Asturias, professor associado de bioquímica da University of Colorado School of Medicine, também são autores seniores. Os principais autores do artigo são o cientista pesquisador do MIT Edward Brignole e o ex-pós-doutorado do Scripps Research Institute Kuang-Lei Tsai, que agora é professor assistente do University of Texas Houston Medical Center.
Uma enzima incomum
A enzima RNR, que é encontrado em todas as células vivas, converte ribonucleotídeos (os blocos de construção do RNA) em desoxirribonucleotídeos (os blocos de construção do DNA). As células devem manter um estoque suficiente desses blocos de construção, mas quando eles acumulam muitos, RNR é desligado por uma molécula de desoxinucleotídeo conhecida como dATP. Quando mais desoxinucleotídeos são necessários, uma molécula relacionada chamada ATP se liga ao RNR e o ativa novamente.
Uma característica incomum do RNR é que ele pode catalisar a produção de quatro produtos diferentes:as bases de nucleotídeos, muitas vezes abreviadas como A, G, C, e T. Em 2016, Drennan descobriu que a enzima consegue isso mudando sua forma em resposta a moléculas reguladoras.
A maioria dos trabalhos anteriores dos pesquisadores sobre a estrutura RNR se concentrou na versão encontrada em E. coli . Para esses estudos, eles usaram cristalografia de raios-X, uma técnica que pode revelar a estrutura atômica e molecular de uma proteína após sua cristalização.
No novo estudo, Drennan e seus colegas começaram a examinar a versão humana do RNR. A estrutura desta proteína, que acabou sendo muito diferente da versão bacteriana, provou ser evasivo usando cristalografia de raios-X, o que não funciona bem para proteínas que não se cristalizam prontamente. Em vez de, os pesquisadores se voltaram para uma forma avançada de microscopia conhecida como microscopia crioeletrônica (crio-EM).
Até recentemente, crio-EM normalmente oferece resolução de cerca de 10 a 20 angstroms, que pode revelar a forma geral de uma proteína, mas nenhum detalhe sobre a posição e a forma de unidades estruturais menores dentro dela. Contudo, nos últimos anos, os avanços tecnológicos levaram a uma explosão no número de estruturas atingindo resoluções de cerca de 3 angstroms. Isso é alto o suficiente para rastrear cadeias de proteínas individuais dentro da molécula maior, bem como estruturas internas como hélices e até cadeias laterais de aminoácidos.
Os cientistas já sabiam que o RNR consiste em duas subunidades de proteínas conhecidas como alfa e beta. Usando cryo-EM, a equipe do MIT descobriu que a versão humana da enzima forma um anel feito de seis das subunidades alfa. Quando ATP, que ativa RNR, está ligado à enzima, o anel é instável e pode ser facilmente aberto, permitindo que a subunidade beta entre no anel. Esta união de alfa e beta permite o sítio ativo da enzima, localizado na subunidade beta, para realizar as reações químicas necessárias para produzir desoxinucleotídeos.
Contudo, quando o inibidor dATP está presente, o anel se torna muito mais rígido e não permite a entrada da subunidade beta. Isso evita que a enzima catalise a produção de desoxinucleotídeos.
Projetando drogas
Vários medicamentos contra o câncer agora em uso ou em desenvolvimento têm como alvo a versão humana do RNR, interferindo na capacidade de reprodução das células cancerosas, limitando seu suprimento de blocos de construção de DNA. A equipe do MIT encontrou evidências de que pelo menos uma dessas drogas, difosfato de clofarabina, funciona induzindo a formação de anéis alfa rígidos de 6 unidades.
Este anel de 6 unidades não é encontrado na forma bacteriana de RNR, que, em vez disso, se reúne em um anel distinto contendo quatro subunidades alfa e quatro subunidades beta. Isso significa que pode ser possível desenvolver antibióticos que tenham como alvo a versão bacteriana, mas não a versão humana, Drennan diz.
Ela agora planeja investigar as estruturas de outras moléculas de proteína que são difíceis de estudar com cristalografia de raios-X, incluindo proteínas com aglomerados de enxofre de ferro, que são encontrados em muitas vias metabólicas. O trabalho de microscopia neste estudo foi realizado no Scripps Research Institute, mas quando o novo edifício MIT.nano do MIT for inaugurado, ele abrigará dois microscópios crio-EM que estarão disponíveis para a comunidade do MIT, bem como para outros usuários em potencial na indústria e na academia.
"Os avanços tecnológicos que permitiram que o crio-EM chegasse a uma resolução tão alta são realmente empolgantes, "Drennan diz." Está realmente começando a revolucionar o estudo da biologia. "