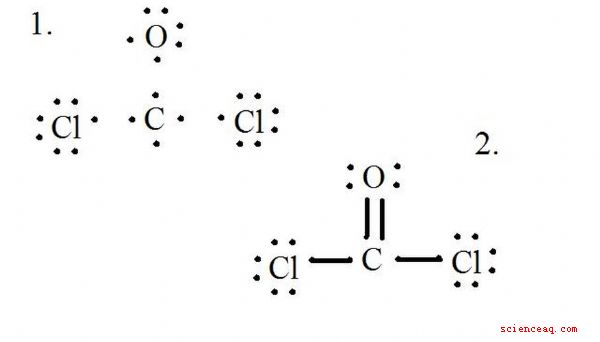
Ao determinar a carga formal de uma molécula como CoCl2 (gás fosgênio), você precisa saber o número de elétrons de valência para cada átomo e a estrutura de Lewis da molécula.
Valence Electron Number
Procure cada átomo na tabela periódica de elementos para determinar o número de elétrons de valência.
Lembre-se que dois elétrons vão na primeira camada de s, dois elétrons na segunda camada de s, seis elétrons na a primeira casca p, etc. Como um lembrete: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6)
Ajuste para carga. Se a molécula é um íon, adicione ou subtraia um ou mais elétrons em geral para explicar a carga final.
Para CoCl2 (gás Fosgênio): C = 4; O = 6; Cl = 7. A molécula não está ionizada e tem uma carga neutra. Portanto, a quantidade total de elétrons de valência é 4 + 6 + (7x2) = 24.
Estrutura de Lewis
Veja o diagrama para a estrutura de Lewis de CoCl2 (gás fosgênio). A estrutura de Lewis representa a estrutura mais estável e provável para uma molécula. Os átomos são desenhados com elétrons de valência emparelhados; ligações são formadas entre elétrons solitários para satisfazer a regra do octeto.
Desenhe cada átomo e seus elétrons de valência, então forme ligações conforme necessário.
Os átomos de cloreto compartilham ligações simples com a molécula de carbono, enquanto o átomo de oxigênio forma uma ligação dupla com o carbono. Cada átomo na estrutura final satisfaz a regra do octeto e tem oito elétrons de valência permitindo estabilidade molecular.
Carga Formal de Cada Átomo
Conte os pares solitários de cada átomo na estrutura de Lewis. Atribua a cada átomo um elétron de cada ligação da qual ele participa. Adicione esses números juntos. Em CoCl2: C = 0 pares solitários mais 4 elétrons de ligações = 4 elétrons. O = 4 elétrons de pares solitários mais 2 elétrons de ligações = 6 elétrons. Cl = 6 elétrons de pares isolados mais 1 elétron de uma ligação com C = 7 elétrons.
Subtraia a soma do número de elétrons de valência no átomo não ligado. O resultado é a carga formal para esse átomo. Em CoCl2: C = 4 elétrons de valência (v.e.) em átomos não ligados menos 4 elétrons designados na estrutura de Lewis (L.s.) = 0 carga formal O = 6 v.e. - 6 L. = 0 carga formal Cl = 7 v.e. - 7 L. = 0 carga formal
Escreva essas acusações ao lado dos átomos na estrutura de Lewis. Se a molécula total tiver uma carga, coloque a estrutura de Lewis entre parênteses com a carga escrita fora dos parêntesis no canto superior direito.
Aviso
O cálculo da carga formal para moléculas contendo metais de transição pode seja complicado. O número de elétrons de valência para metais de transição será aquele fora do núcleo de gás nobre.