Engenharia de eletrocatalisadores de metais não preciosos para separação de água econômica e ambientalmente responsável
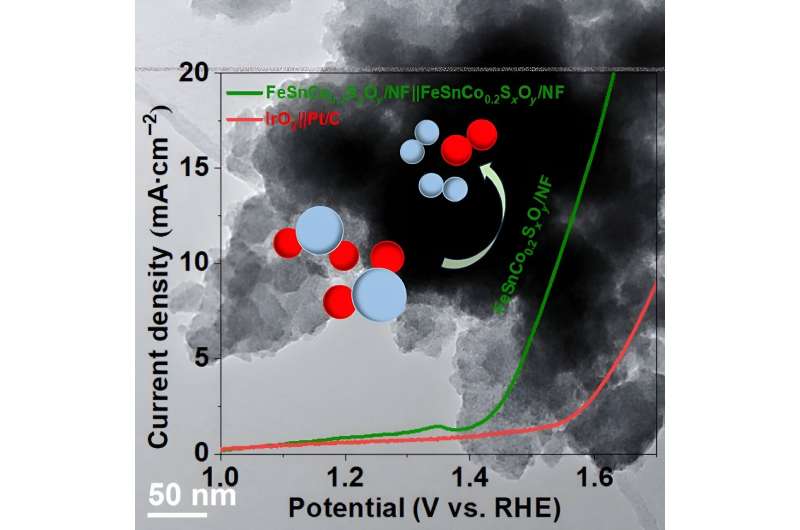 O alvo do estudo,FeSnCo0,2 Sx Oy /NF (linha verde), requer menos voltagem para induzir reações de evolução de oxigênio (OER) e reações de evolução de hidrogênio (HER) do que IrO2 ||Pt/C (linha vermelha). Crédito:Jinqi Guan, Universidade de Jilin
O alvo do estudo,FeSnCo0,2 Sx Oy /NF (linha verde), requer menos voltagem para induzir reações de evolução de oxigênio (OER) e reações de evolução de hidrogênio (HER) do que IrO2 ||Pt/C (linha vermelha). Crédito:Jinqi Guan, Universidade de Jilin Existe uma luta constante para reduzir as fontes de energia baseadas em carbono e substituí-las por alternativas com baixo ou nenhum carbono. O processo de divisão da água pode ser a solução.
A produção de hidrogênio é um método simples, seguro e eficaz para produzir mais energia do que a gasolina, pelo simples processo de divisão da água. A recolha de energia desta forma, em vez de depender fortemente (ou mesmo depender) de fontes de energia baseadas no carbono, está a tornar-se cada vez mais a norma. Os pesquisadores descobriram um método para usar sulfetos de metais de transição, como estanho (Sn), cobalto (Co) e ferro (Fe) em espuma de níquel, para desenvolver eletrocatalisadores de metais não preciosos para uso em divisão de água econômica e ambientalmente responsável.
Os pesquisadores publicaram seus resultados na
Nano Research Energy .
Para ter sucesso neste empreendimento de redução de carbono, algumas reações precisam ser estabilizadas para este processo. A estrela do estudo é FeSnCo
0,2 Sexo Ó
você /NF, que pode atuar tanto como ânodo quanto como cátodo no processo de divisão da água em baixa tensão.
As duas reações preocupantes aqui são as reações de evolução de oxigênio (OER) e as reações de evolução de hidrogênio (HER). REA gera O
2 através de uma reação química da água. ELA produz H
2 de uma reação de transferência de dois elétrons. O H
2 resultante é útil como combustível. Usar ambas as reações é ideal para criar um eletrocatalisador bifuncional. Os eletrocatalisadores podem ser definidos como catalisadores (ou iniciadores de reação) que funcionam nas superfícies dos eletrodos, que são superfícies que podem transportar corrente elétrica.
O HER provou ser estável após 55 horas de uso contínuo e também requer um sobrepotencial menor que o OER. Sobrepotencial é a diferença na quantidade de energia necessária para um determinado catalisador operar.
Infelizmente, a estabilidade dos REA não está onde deveria estar. Isto se deve parcialmente à etapa extra envolvida na transferência de elétrons, mas também porque os eletrólitos sob os quais funcionam são normalmente agressivos. Embora o REA seja estável com uso contínuo por cerca de 70 horas, sua atividade diminui com maior teor de cobalto.
"É fundamental melhorar a estabilidade REA dos sulfetos de metais de transição para que eles possam ser usados como catalisadores bifuncionais de HER e REA para células a combustível de hidrogênio reversíveis", disse Jingqi Guan, autor e pesquisador do estudo.
OER também tem um sobrepotencial maior que o HER. Com uma quantidade maior de energia necessária para induzir a operação do catalisador, o REA pode ser mais "difícil". No entanto, a combinação de ferro, estanho e cobalto na espuma de níquel apresenta alguma melhoria na estabilidade bifuncional e na atividade de HER e REA.
A combinação desses metais e as interfaces heteroestruturais formadas podem ajustar a distribuição dos elétrons através da superfície do eletrólito. "Heteroestrutural" aqui se refere a um semicondutor que pode ter uma composição química alterada com base na posição em que os dois produtos químicos estão. Neste caso, é uma dupla sulfeto/oxihidróxido.
A distribuição uniforme de elétrons ajuda a aumentar a taxa de transferência de carga em toda a estrutura, o que promove a transferência de elétrons. Devido à natureza deste semicondutor, aumentar a estabilidade naturalmente melhoraria a atividade e função geral.
No geral, estes metais de transição têm um efeito sinérgico entre si, especialmente quando submetidos a HER. Este efeito os torna candidatos ideais para o principal desafio proposto pelos pesquisadores:reduzir as fontes de energia baseadas em carbono.
Embora os resultados tenham sido muito promissores, sempre há etapas que podem ser tomadas no futuro para aperfeiçoar um processo. Encontrar um catalisador que minimize os sobrepotenciais pode reduzir a entrada de energia necessária para catalisar a reação. Além disso, garantir que os eletrocatalisadores desenvolvidos sejam duráveis o suficiente para serem usados comercialmente e possam suportar longas horas de uso contínuo sem quaisquer efeitos nocivos é fundamental para o sucesso a longo prazo das interfaces heteroestruturais.
Mais informações: Siyu Chen et al, Engenharia de interface de eletrocatalisador heteroestrutural de sulfeto de Fe-Sn-Co/oxihidróxido para divisão sinérgica de água,
Nano Research Energy (2023). DOI:10.26599/NRE.2023.9120106
Fornecido pela Imprensa da Universidade de Tsinghua
