Produção in vivo de células CAR-T usando nanovesículas fusogênicas miméticas de vírus
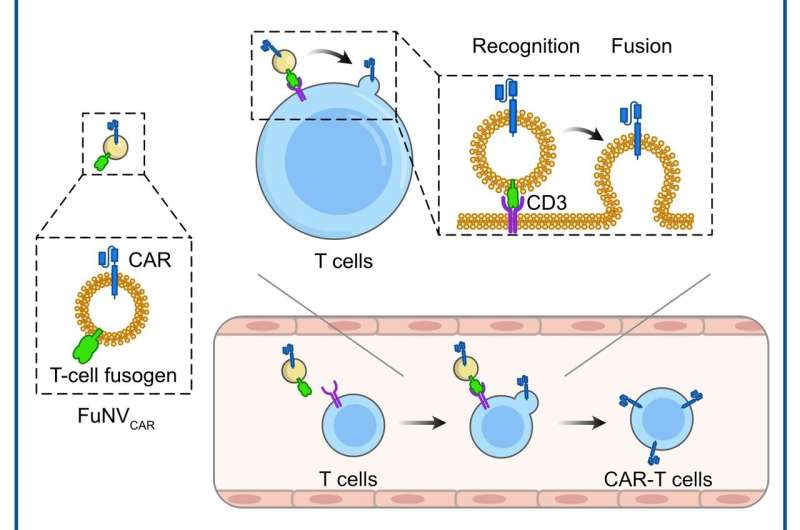 A nanovesícula fusogênica mimética de vírus (FuNV) pode se fundir eficientemente com células T in vivo, entregando assim o receptor de antígeno quimérico (CAR) anti-CD19 (αCD19) carregado em células T para produzir células CAR-T αCD19. Estas células αCD19 CAR-T projetadas in vivo mostram uma inibição eficaz do linfoma de células B. Crédito:Science China Press
A nanovesícula fusogênica mimética de vírus (FuNV) pode se fundir eficientemente com células T in vivo, entregando assim o receptor de antígeno quimérico (CAR) anti-CD19 (αCD19) carregado em células T para produzir células CAR-T αCD19. Estas células αCD19 CAR-T projetadas in vivo mostram uma inibição eficaz do linfoma de células B. Crédito:Science China Press Os receptores de antígenos quiméricos (CARs) são proteínas de membrana sintetizadas que permitem aos linfócitos reconhecer e responder aos antígenos específicos das células-alvo. Apesar da impressionante eficácia da terapia com células CAR-T no tratamento de linfoma de células B ou leucemia, o processo de fabricação caro e complexo tem dificultado a sua ampla aplicação clínica.
Pesquisas anteriores exploraram o uso de nanopartículas para fornecer ácidos nucleicos para programar células T circulantes in vivo, agilizando a geração de células CAR-T e evitando a necessidade de isolar células T de pacientes. Enquanto isso, a inserção da proteína CAR diretamente na membrana das células T poderia apresentar um método simples, contornando complicações como a síndrome de liberação de citocinas (SRC) e o risco tumorigênico associado à inserção aleatória de genes virais no genoma.
Liderados pelo Prof. Jun Wang e pelo Prof. Cong-Fei Xu da Escola de Ciências Biomédicas e Engenharia da Universidade de Tecnologia do Sul da China, os pesquisadores desenvolveram uma estratégia promissora que envolve a fusão direta de moléculas CAR, pré-expressas em nanovesículas fusogênicas. (FuNVs), para células T, construindo assim células CAR-T in vivo.
Eles projetaram o fusogênio de células T adicionando um fragmento variável de cadeia única anti-CD3 ao reovírus ou ao fusogênio do vírus do sarampo. Eles demonstraram que os FuNVs derivados de células que expressam fusogênio de células T transportavam uma quantidade substancial de fusogênio de células T, o que induziu eficientemente a fusão entre NVs e células T tanto in vitro como in vivo.
Posteriormente, considerando o sucesso clínico das células CAR-T anti-CD19 (αCD19), as células projetadas que expressam fusogênio de células T e proteína CAR αCD19 foram construídas para produzir FuNVs portadores de CAR αCD19 (FuNVCAR ). A produção de células CAR-T foi alcançada com sucesso através da entrega de proteína CAR em células T via FuNVCAR in vitro e in vivo. Enquanto isso, injeção intravenosa de FuNVCAR inibiu efetivamente o crescimento do linfoma de células B.
Para explorar ainda mais a toxicidade potencial do FuNVCAR , hemogramas e análises bioquímicas séricas foram realizados aos 2 dias e 14 dias, demonstrando comparabilidade com o grupo controle. Ao longo do tratamento com FuNVCAR , não foram observadas alterações significativas no peso corporal em camundongos.
Além disso, em contraste com o tratamento tradicional com células CAR-T, o tratamento com FuNVCAR não induziu uma liberação elevada de citocinas inflamatórias. Esta diferença observada pode ser atribuída a células CAR-T transitórias produzidas por FuNVCAR , que sofre ativação limitada e temporária, mitigando a liberação sustentada de citocinas inflamatórias.
Em resumo, este estudo introduz uma nova abordagem para a produção de células CAR-T in vivo através da entrega de proteína CAR mediada por FuNV. É essencial notar, no entanto, que esta estratégia pode não ser adequada para pacientes com função comprometida das células T.
As descobertas foram publicadas na revista Science Bulletin .
