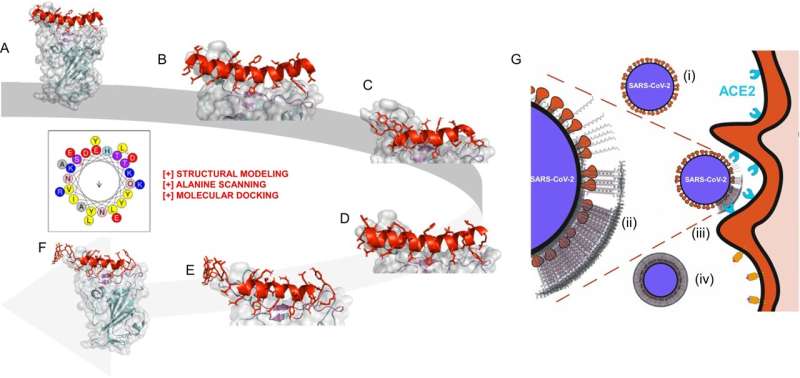
 Estratégia de design de peptídeos de automontagem (SAPs) como inibidores direcionados do SARS-CoV-2. Crédito:Nature Communications (2024). DOI:10.1038/s41467-024-45193-3
Estratégia de design de peptídeos de automontagem (SAPs) como inibidores direcionados do SARS-CoV-2. Crédito:Nature Communications (2024). DOI:10.1038/s41467-024-45193-3 As vacinas continuam a ser o padrão-ouro de proteção contra agentes patogénicos perigosos, mas o seu desenvolvimento exige um tempo considerável e vastos recursos. Vírus que sofrem mutações rápidas, como o SARS-CoV-2, podem diminuir a sua eficácia e até torná-los obsoletos.
Para colmatar estas lacunas, uma equipa multi-universitária liderada por Vivek Kumar, do Instituto de Tecnologia de Nova Jersey, está a desenvolver uma terapia de hidrogel que actua como primeira linha de defesa contra vírus e outras ameaças biológicas. Os peptídeos que compõem este gel evitam que vírus como o SARS-CoV-2, que causa o COVID-19, se liguem e entrem nas células. Eles fazem isso ligando-se a um receptor específico no patógeno invasor, ao mesmo tempo que se agregam em uma “máscara molecular” multicamadas que abafa sua ação.
Ao longo da pesquisa, a equipe descobriu que a máscara molecular por si só prevenia infecções. A vantagem potencial desta nova tecnologia, dizem eles, é a sua capacidade de combater diversos agentes patogénicos e mutações de doenças.
“Proteger as pessoas nas fases iniciais de um surto é importante”, disse Kumar, professor associado de engenharia biomédica. “Nosso novo mecanismo também poderia ajudar os socorristas na linha de frente, militares que encontram novos patógenos, pessoas em áreas remotas e com poucos recursos e aqueles que não podem receber vacinas”.
O objetivo a curto prazo é produzir um spray nasal contra infecções transmitidas pelo ar.
Em um estudo publicado na revista Nature Communications , a equipe descreveu como a máscara se liga de forma não específica ao seu alvo. É composto de peptídeos projetados computacionalmente (cadeias de aminoácidos que formam proteínas) que se automontam em hidrogéis fibrosos em nanoescala. Em comparação, os anticorpos produzidos pelas vacinas têm como alvo receptores específicos, como as vacinas de mRNA desenvolvidas durante a pandemia que se ligam a proteínas específicas no pico do SARS-CoV-2.
A descoberta da equipe surgiu de pesquisas no início da pandemia sobre novas abordagens para evitar que o vírus invadisse as células. O projeto inicial, envolvendo peptídeos direcionados ao pico do SARS-CoV-2, analisou domínios altamente específicos. No entanto, os géis peptídicos não específicos que eles também desenvolveram formaram uma fibra multicamadas no topo do vírus.
O grupo postulou que as cargas negativas nas fibras interagem com proteínas com cargas diferentes na superfície viral, mascarando-as e impedindo-as de interagir com as células nativas.
 Com investigadores no seu laboratório, o engenheiro biomédico Vivek Kumar desenvolveu uma terapia de hidrogel que, nos primeiros testes, impediu que o SARS-Cov-2 infectasse células sem atingir receptores específicos no pico. Crédito:NJIT
Com investigadores no seu laboratório, o engenheiro biomédico Vivek Kumar desenvolveu uma terapia de hidrogel que, nos primeiros testes, impediu que o SARS-Cov-2 infectasse células sem atingir receptores específicos no pico. Crédito:NJIT
Sobre a máscara de proteína inespecífica, Kumar observou:"Ela forma uma estrutura maior e se liga melhor do que uma única molécula. Embora não tenha alta especificidade, pode se automontar e permanecer no alvo por mais tempo, formando uma fibra adesivo na superfície que age como velcro molecular."
Ele acrescentou:“O objetivo seria um agente tópico que se ligasse ao vírus. No caso do SARS-CoV-2, pulverizaríamos no nariz, que é um importante local de infecção, talvez até profilaticamente”.
A equipe primeiro testou as fibras contra vários vírus por meio de simulações de computador que empregavam poderosas placas gráficas NVIDIA, comumente usadas em jogos competitivos. Posteriormente, eles realizaram testes de segurança bem-sucedidos com camundongos e ratos, usando injeções e sprays nasais, disse Joseph Dod-o, Ph.D. estudante do laboratório de Kumar que conduziu grande parte da pesquisa sobre a terapia junto com Abhishek Roy, também Ph.D. estudante. A terapia inibiu as variantes alfa e ômicron do SARS-CoV-2 in vitro, durando um dia sem prejudicar os animais nos testes in vivo.
Kumar desenvolveu hidrogéis para diversas aplicações terapêuticas. Seu mecanismo de entrega é personalizável e composto por filamentos de peptídeos semelhantes a Lego com um agente bioativo anexado em uma extremidade que pode sobreviver no corpo por semanas e até meses, onde outros biomateriais se degradam rapidamente. Suas ligações automontáveis são projetadas para serem mais fortes do que as forças dispersivas do corpo; forma fibras estáveis, sem sinais de induzir inflamação.
O hidrogel é projetado para desencadear diferentes respostas biológicas dependendo da carga anexada. O laboratório de Kumar publicou pesquisas sobre aplicações que vão desde terapias para estimular ou prevenir a criação de novas redes de vasos sanguíneos, para reduzir a inflamação e para combater micróbios.
“Neste caso, estamos usando cargas elétricas que interagem com o patógeno para interrompê-lo”, disse Kumar.
"Ainda estamos tentando determinar como as fibras interagem:este é um modo de ação mecânico? Os patógenos resistentes aos medicamentos sofrem mutação em torno de moduladores bioquímicos, mas será que são menos propensos a sofrer mutação em torno de uma lança mecânica? Ao compreender esta interação fundamental, queremos descobrir como usá-lo contra diferentes doenças."
Em novos estudos, o laboratório está testando a terapia contra bactérias e fungos resistentes a medicamentos.
Os membros da equipe trazem conhecimentos variados:design computacional na Universidade de Illinois em Chicago; capacidades bioanalíticas na Georgia Tech e Baylor School of Medicine; estudos de virologia na Rutgers University; e experiência em plataforma, análise e ensaio no NJIT.

