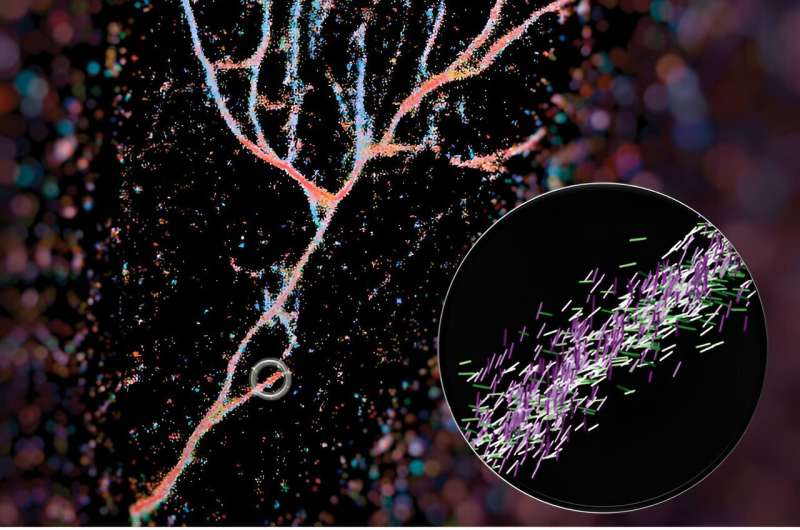
 A microscopia de orientação-localização de molécula única captura a fluorescência das moléculas vermelhas do Nilo à medida que elas se ligam transitoriamente a fibrilas compostas de peptídeos KFE8 projetados. Crédito:Weiyan Zhou
A microscopia de orientação-localização de molécula única captura a fluorescência das moléculas vermelhas do Nilo à medida que elas se ligam transitoriamente a fibrilas compostas de peptídeos KFE8 projetados. Crédito:Weiyan Zhou Uma nova técnica de imagem desenvolvida por engenheiros da Universidade de Washington em St. Louis pode dar aos cientistas uma visão muito mais detalhada dos conjuntos de fibrilas – pilhas de peptídeos que incluem beta amilóide, mais notavelmente associados à doença de Alzheimer.
Esses conjuntos de fibrilas β cruzadas também são blocos de construção úteis em biomateriais projetados para aplicações médicas, mas sua semelhança com seus primos beta amilóides, cujos emaranhados são um sintoma de doença neurodegenerativa, é preocupante. Os pesquisadores querem aprender como as diferentes sequências desses peptídeos estão ligadas à sua toxicidade e função variadas, tanto para os peptídeos que ocorrem naturalmente quanto para seus primos geneticamente modificados.
Agora, os cientistas podem observar de perto os conjuntos de fibrilas para ver que há diferenças notáveis na forma como os peptídeos sintéticos se acumulam em comparação com o beta amilóide. Esses resultados resultam de uma colaboração frutífera entre o autor principal Matthew Lew, professor associado de engenharia elétrica e de sistemas, e Jai Rudra, professor associado de engenharia biomédica, na Escola de Engenharia McKelvey da WashU.
“Projetamos microscópios para permitir melhores medições em nanoescala para que a ciência possa avançar”, disse Lew.
Em um artigo publicado recentemente na ACS Nano , Lew e colegas descrevem como usaram a sonda química vermelha do Nilo para iluminar fibrilas β cruzadas. Sua técnica, chamada microscopia de orientação-localização de molécula única (SMOLM), usa flashes de luz do vermelho do Nilo para visualizar as estruturas de fibra formadas por peptídeos sintéticos e por beta amilóide.
Conclusão:essas montagens são muito mais complicadas e heterogêneas do que se previa. Isso é uma boa notícia porque significa que há mais de uma maneira de empilhar proteínas com segurança. Com melhores medições e imagens de conjuntos de fibrilas, os bioengenheiros podem compreender melhor as regras que ditam como a gramática das proteínas afeta a toxicidade e a função biológica, levando a terapêuticas mais eficazes e menos tóxicas.
Primeiro, os cientistas precisam ver a diferença entre eles, algo muito desafiador devido à pequena escala destes conjuntos.
“A torção helicoidal destas fibras é impossível de discernir usando um microscópio óptico, ou mesmo alguns microscópios de super-resolução, porque estas coisas são demasiado pequenas”, disse Lew.
Com a tecnologia de imagem de alta dimensão desenvolvida no laboratório de Lew nos últimos dois anos, eles são capazes de ver as diferenças.
Um microscópio de fluorescência típico usa moléculas fluorescentes como lâmpadas para destacar certos aspectos de um alvo biológico. No caso deste trabalho, eles usaram uma dessas sondas, a Nile Red, como sensor do que estava ao seu redor. À medida que o vermelho do Nilo explora aleatoriamente o seu ambiente e colide com as fibrilas, emite flashes de luz que podem ser medidos para determinar onde está a sonda fluorescente e a sua orientação. A partir desses dados, eles podem reunir o quadro completo das fibrilas projetadas que se acumulam de maneira muito diferente das naturais, como a beta amilóide.
A imagem desses conjuntos de fibrilas foi capa da ACS Nano e foi elaborado pelo primeiro autor Weiyan Zhou, que codificou a imagem com base em onde os vermelhos do Nilo apontavam. A imagem resultante é um conjunto de peptídeos fluindo em vermelho azulado que se parece com o vale de um rio.
Os pesquisadores planejam continuar a desenvolver técnicas como o SMOLM para abrir novos caminhos no estudo de estruturas e processos biológicos em nanoescala.
“Estamos vendo coisas que você não pode ver com a tecnologia existente”, disse Lew.
