As nanocápsulas fornecem uma nova solução para a terapia quimiodinâmica eficiente do câncer
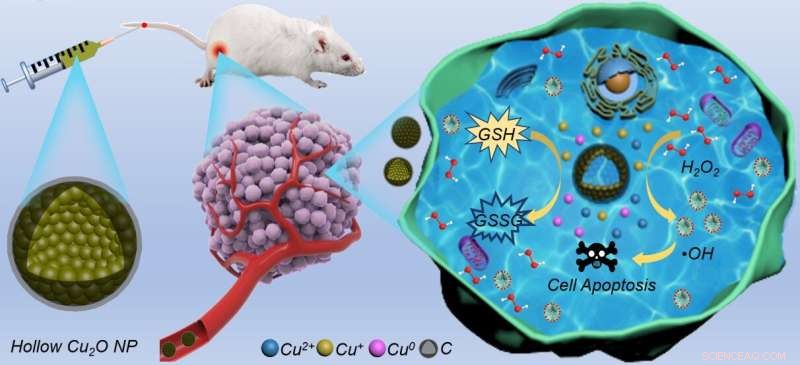
Ilustração esquemática da reação em cascata catalisada por HCONC para oncoterapia quimiodinâmica. Crédito:Wang Hui
Em um artigo publicado em
Pequeno recentemente, uma equipe de pesquisa colaborativa liderada pelo Prof. Wang Hui do High Magnetic Field Laboratory, Hefei Institutes of Physical Science (HFIPS), Chinese Academy of Sciences (CAS) relatou a síntese de óxido cuproso oco@carbono dopado com nitrogênio (HCONC) por método hidrotérmico de uma etapa, bem como suas aplicações na terapia quimiodinâmica eficiente.
Nos últimos anos, a terapia quimiodinâmica (CDT) responsiva ao microambiente tumoral (TME) tem recebido grande atenção devido à sua baixa invasividade e alta seletividade. Entre vários nanocatalisadores à base de metais, o baixo potencial redox do Cu
+
/Cu
2+
em nanocatalisadores à base de cobre os dota de maiores rendimentos de espécies reativas de oxigênio (ROS) e superexpressão reduzida de glutationa (GSH), que também pode se mostrar uma grande promessa como um agente do tipo Fenton em condições relativamente fracas. No entanto, a suscetibilidade à oxidação e potencial toxicidade iônica de nanocatalisadores à base de cobre limitam severamente suas aplicações em nanomedicina. Portanto, é necessário desenvolver um nanocatalisador à base de cuproso com boa biocompatibilidade para esgotar a superexpressão de GSH para aumentar a CDT.
Nesta pesquisa, os pesquisadores usaram um método hidrotérmico de uma etapa para sintetizar nanocápsulas de HCONC para catalisar a reação em cascata e melhorar a eficácia do CDT. Essas "nanocápsulas" compostas por nanopartículas não são "cápsulas" no sentido tradicional. É uma estrutura de núcleo-casca formada por engenhosamente anexando uma fina camada de carbono à superfície de óxido cuproso oco (Cu
2 O) nanocristais, que não só previnem eficazmente a oxidação do Cu
+
, mas também aumenta a estabilidade do Cu
2 O nanocristais.
O Cu
+
A reação do tipo Fenton mediada no HCONC pode catalisar eficientemente H
2 O
2 para gerar ·OH, e o Cu
+
liberado no TME também pode decompor o GSH superexpresso para proteger ROS nascentes.
Tanto os experimentos in vitro quanto os in vivo mostram que o HCONC possui excelente capacidade antitumoral sem causar toxicidade sistêmica. "Todo o processo pode ser descrito em um antigo ditado", acrescentou o professor Wang, "à medida que o medicamento fez efeito, os sintomas diminuíram".
+ Explorar mais Terapia de sinergia de infravermelho próximo para nanoclusters de câncer
