Nanocápsula com uma ferramenta de edição CRISPR-Cas9 usada para entrega cerebral não invasiva e segmentação de células tumorais
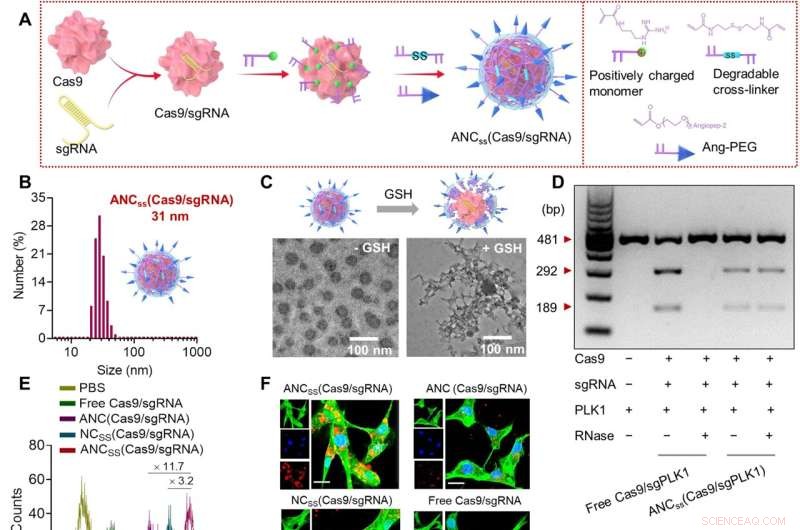
Fabricação, propriedades físicas e função celular de nanocápsulas de Cas9/sgRNA. (A) A polimerização de radicais livres in situ foi usada para sintetizar nanocápsulas reticuladas por dissulfeto contendo Cas9/sgRNA e funcionalizadas com ligante de direcionamento angiopep-2. (B) Distribuição de tamanho de ANCSS (Cas9/sgRNA) nanocápsulas determinadas por espalhamento dinâmico de luz. (C) imagens TEM de ANCSS (Cas9/sgRNA) com ou sem tratamento com GSH. (D) Análise de eletroforese em gel do ANCSS (Cas9/sgPLK1) ou Cas9/sgPLK1 livre com ou sem tratamento com RNase (1 mg/ml, 30 min). (E) Citometria de fluxo de células U87MG após 4 horas de incubação com ANCSS (Cas9/sgRNA) ou controles. (F) Imagens de microscopia de varredura a laser confocal (CLSM) de células U87MG após 4 horas de incubação com ANCSS (Cas9/sgRNA) ou controles. Cas9 foi marcado com Alexa Fluor 647 (AF647; vermelho); o citoesqueleto foi corado com Alexa Fluor 488 (verde), e os núcleos foram corados com Hoechst 33342 (azul). Para (E) e (F), a concentração de AF647-Cas9 foi de 20 nM. Barras de escala, 20 μm. (G) Eficiência de edição do gene Luciferase em células U87MG-Luc incubadas com ANCSS (Cas9/sgRNA) ou controles por 72 horas. Os dados são apresentados como média ± DP (n =5; *P <0,05, **P <0,01 e ***P <0,001). (H) Indels do gene PLK1 em células U87MG transfectadas com ANCSS (Cas9/sgPLK1) ou controles por 48 horas. (I) Esquema de edição de genes no núcleo. (J) Níveis de expressão de PLK1 em células U87MG após 72 horas de incubação com ANCSS (Cas9/sgPLK1) ou controles. (K) Ensaio de apoptose de células U87MG após 72 horas de incubação com ANCSS (Cas9/sgRNA) e outros controles. Para (G) a (K), a concentração de Cas9 foi de 20 nM. bp, pares de bases; PBS, solução salina tamponada com fosfato. Crédito:Avanços Científicos (2022). DOI:10.1126/sciadv.abm8011
Uma equipe internacional de pesquisadores desenvolveu uma nanocápsula capaz de atravessar a barreira hematoencefálica (BBB) para transportar a ferramenta de edição CRISPR-Cas9 para tratar um tumor cerebral. Em seu artigo publicado na revista
Science Advances, o grupo descreve como eles criaram sua cápsula e como ela funcionou quando testada em camundongos com glioblastoma.
Os glioblastomas são notoriamente difíceis de tratar. Os tumores aparecem no cérebro e seu crescimento danifica o tecido. As opções de tratamento incluem remoção cirúrgica, injeções diretas de terapias destinadas a matar as células cancerígenas ou inserir vírus CRISPR na corrente sanguínea. Cada uma dessas opções tem uma desvantagem, desde tecido cerebral danificado até ineficácia devido a dificuldades com terapias que cruzam o BBB. Nesse novo esforço, os pesquisadores tentaram uma nova abordagem, usando uma nanocápsula para transportar a ferramenta de edição CRISPR-Cas9 para o tumor cerebral, onde visa um gene responsável pelo desenvolvimento de novas células – uma cápsula capaz de cruzando o BBB.
O invólucro da nanocápsula foi criado usando um polímero reticulado de dissulfeto que foi então pontilhado com um peptídeo angiopep-2. O peptídeo foi adicionado para criar uma carga de superfície neutra para que não fosse atacado pela ribonuclease. A casca era grande o suficiente para conter um complexo Cas9, mas ainda pequena o suficiente (aproximadamente 30 nanômetros de comprimento) para permitir que passasse pelo BBB.
Os pesquisadores testaram seu sistema de entrega de nanocápsulas em modelos de camundongos com glioblastoma. Cada um recebeu uma injeção de cauda única – alguns receberam o sistema de entrega de nanocápsulas recém-desenvolvido, enquanto outros receberam um controle. Os pesquisadores descobriram que os camundongos que receberam a nova terapia tiveram um tempo médio de sobrevivência de 68 dias em comparação com 24 dias para o grupo controle. Eles também encontraram uma taxa de mutação genética indesejada inferior a 0,5% em outros tecidos cerebrais.
Os pesquisadores sugerem que seu trabalho representa um novo passo em direção a abordagens não invasivas e não virais para o tratamento de glioblastomas, embora reconheçam que muito mais trabalho precisa ser feito antes que possa ser determinado se a mesma abordagem será segura e eficaz em humanos.
+ Explorar mais Cápsulas minúsculas oferecem alternativa à entrega viral de terapia genética
© 2022 Science X Network
