Pesquisadores usam nanotecnologia para destruir e prevenir recaídas de cânceres de tumores sólidos
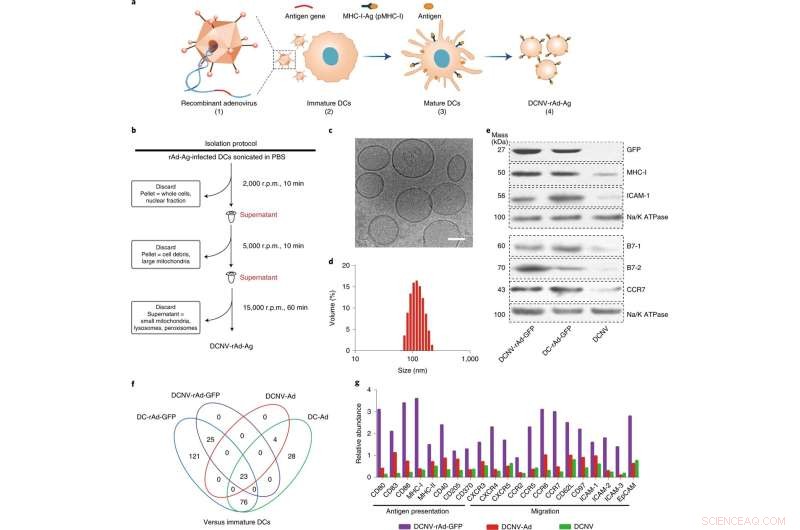
Geração e caracterização de DCNV-rAd-Ag. a, Geração de DCNVs derivadas de células dendríticas maduras infectadas com adenovírus. (1) Os genes do antígeno específico do tumor foram geneticamente modificados no vetor de adenovírus. (2) O adenovírus recombinante infectou as células imaturas DC2.4 para expressar o antígeno modificado na superfície celular e estimulá-lo. (3) Diferenciação, maturação e apresentação de antígenos. (4) Colheita da membrana celular madura induzida e preparação de DCNV-rAd-Ag. b, Ilustração esquemática da geração de DCNV-rAd-Ag. c,d, microscopia crioeletrônica (c) e análise dinâmica de espalhamento de luz (d) mostraram DCNV-rAd-Ag uniforme (aproximadamente 108 nm de diâmetro médio, índice de polidispersidade =0,14) com uma morfologia tipo vesícula. Barra de escala, 50 nm. e, O Western blot em proteínas de membrana de DCNV-rAd-GFP demonstra um conteúdo de proteína semelhante na superfície em comparação com o das células parentais. Os painéis c–e mostram resultados representativos de dois experimentos independentes com resultados semelhantes. f, Comparação de proteínas relacionadas à resposta imune reguladas positivamente em NVs e DCs. g, A abundância relativa de apresentação de antígeno e proteínas relacionadas à migração em DCNV-rAd-GFP. r.p.m., revoluções por minuto. CCR, receptor de quimiocina CC; CXCR, receptor de quimiocina C-X-C; EpCAM, molécula de adesão celular epitelial; ICAM 1, molécula de adesão intercelular 1; pMHC-I, complexo peptídeo-principal de histocompatibilidade classe I. Crédito:Nature Nanotechnology (2022). DOI:10.1038/s41565-022-01098-0
À medida que as pessoas em todo o mundo anseiam por expectativas de vida mais longas, os cânceres malignos continuam a representar ameaças à saúde humana. A exploração e desenvolvimento da imunoterapia visa buscar novos avanços para o tratamento de tumores sólidos.
O estabelecimento bem-sucedido da imunidade antitumoral requer a ativação, expansão e diferenciação de linfócitos antígeno-específicos. Esse processo depende em grande parte de interações específicas entre várias células T e células apresentadoras de antígenos (APCs) no corpo. No entanto, as vacinas tumorais existentes, como vacinas de neoantígenos e várias vacinas de vetores, dependem de interações aleatórias com APCs no corpo. Além disso, interações inadequadas podem levar ao silenciamento de outras respostas imunes.
Embora a imunoterapia baseada em checkpoints imunológicos tenha demonstrado grande potencial, apenas uma pequena proporção de pacientes responde totalmente a essa terapia, e os mecanismos moleculares relevantes precisam ser mais explorados. Este método de entrega é, no entanto, complexo e ineficiente.
Em um desenvolvimento inovador, uma equipe de cientistas liderada pelo professor Narat Muzayyin, professor Chen Xiaoyuan, da Escola de Medicina NUS Yong Loo Lin, e pelo professor Liu Gang, da Universidade de Xiamen, formulou uma nova vacina que mostrou alta eficácia no tratamento de tumores sólidos, alcançando eliminação completa de tumores sólidos e indução de memória imunológica de longa duração. Isso evita a recaída do crescimento do tumor que o paciente apresentou originalmente e fornece imunidade contra tipos de tumor semelhantes. Isso foi comprovado através da aplicação desta vacina em modelos de tumor de melanoma. Seus resultados são publicados em
Nature Nanotechnology .
A equipe conseguiu projetar uma membrana de célula dendrítica (um tipo de APC) que foi usada para estimular naturalmente o sistema imunológico e ativar a imunidade antitumoral multidimensional. Isso foi feito por meio de uma plataforma de vacina de nanovesículas de autoapresentação de antígeno e reversão de imunossupressão, que levou a equipe a cunhar seu apelido, ASPIRE.
O sistema de vacina ASPIRE pode eliciar rapidamente respostas imunes específicas de antígenos apropriadas de uma forma que os métodos tradicionais de vacinas não poderiam. Este modo de apresentação de antígeno melhora muito a eficiência da ativação imune, o que facilita a alta eficácia desta nova vacina em relação a outras vacinas atualmente disponíveis. Além disso, a vacina também pode ativar células T não expostas anteriormente e células T esgotadas, o que facilita as capacidades imunes antitumorais superiores do ASPIRE.
“Estamos entusiasmados com o potencial desta tecnologia de plataforma para aplicação adicional em outras doenças, como a infecção viral crônica, na qual a exaustão das células T geralmente ocorre durante a infecção e impede o controle viral ideal”, disse o professor Chen. "Em seguida, a equipe espera estabelecer um procedimento operacional padrão para síntese em escala da vacina, com controle de qualidade adequado das vesículas da membrana, para tradução clínica", acrescentou.
Falando de forma independente sobre o estudo, o professor Chng Wee Joo, consultor sênior da Divisão de Hematologia do Departamento de Hematologia-Oncologia do Instituto Nacional de Câncer da Universidade de Cingapura e especialista em mieloma, disse:"O campo da imunoterapia contra o câncer está oferecendo uma tremenda esperança ao câncer No entanto, existem algumas deficiências com as tecnologias atuais. A presente inovação do Prof Chen e seus colegas superou algumas dessas deficiências e melhorou a eficácia e
sustentabilidade da resposta imune a esses tratamentos. Isso fornecerá um avanço que terá um impacto importante sobre os pacientes."
+ Explorar mais Nanotecnologia de vacina emergente
