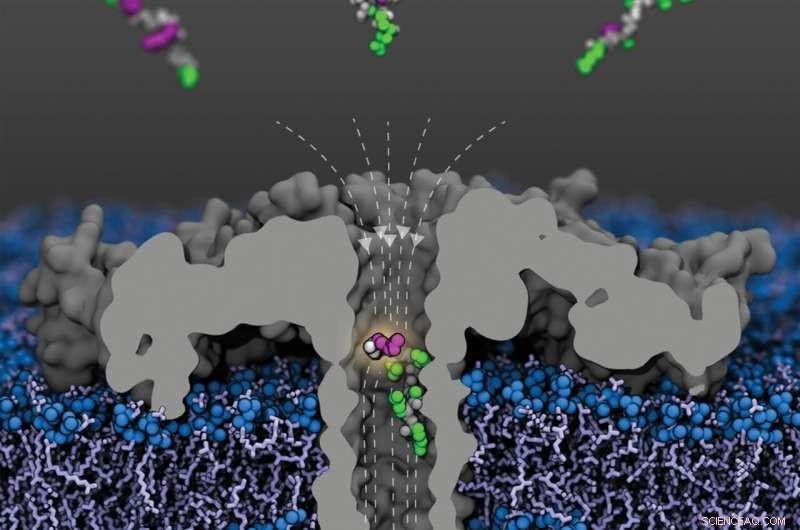
Vista aberta do poro de aerolisina modificado (R220S) (cinza) com linhas de campo (tracejadas) em uma membrana lipídica. Fragmentos da proteína histona 4 humana acetilada em vários resíduos de lisina chegam do compartimento superior; um fragmento acetilado em lisina-8 é mostrado dentro do poro. As cadeias peptídicas são mostradas em cinza, as cadeias laterais não modificadas em verde e as lisinas acetiladas em roxo. Crédito:Sarthak Kumar, Universidade de Illinois em Urbana-Champaign
Alterações conhecidas como modificações epigenéticas desempenham um papel importante no desenvolvimento do câncer. Ser capaz de analisá-los de forma rápida e confiável pode contribuir significativamente para o desenvolvimento da terapia personalizada. Uma equipe de pesquisa do Instituto de Fisiologia da Universidade de Freiburg conseguiu agora caracterizar as mudanças químicas nas proteínas que são típicas das modificações epigenéticas usando a análise de nanoporos. Os pesquisadores publicaram seus resultados de pesquisa no
Journal of the American Chemical Society (
JACS ).
Nos últimos anos, os nanoporos tornaram-se uma ferramenta amplamente aplicável para a análise de moléculas. Devido às suas propriedades especiais, eles permitem que a estrutura das moléculas seja analisada em frações de segundo:Como proteínas dispostas cilíndrica, os nanoporos formam minúsculos canais com apenas alguns milionésimos de milímetro (nanômetro) de diâmetro que podem ser incorporados em biomembranas.
"Para os experimentos, aplicamos uma voltagem constante através da membrana para que os íons do meio circundante fluam através do poro. Isso cria uma corrente elétrica constante e mensurável com precisão", explica o Prof. Dr. Jan C. Behrends da Faculdade de Medicina. na Universidade de Freiburg, em cujo laboratório ocorreram os experimentos agora publicados. No entanto, quando uma molécula migra para o poro, a corrente é bloqueada:quanto maior a molécula, mais fortemente ela é bloqueada também.
Uma proteína em destaque na pesquisa:H4 No contexto das experiências agora publicadas, os cientistas de Freiburg dedicaram-se à investigação da chamada proteína histona H4. Essa proteína está firmemente associada ao DNA em todas as células com núcleo e é um dos alvos de modificações epigenéticas mais bem pesquisados. Uma região na extremidade N-terminal da proteína é particularmente afetada por essas modificações.
"A sequência de proteínas contém o aminoácido lisina várias vezes", explica Behrends. Grupos acetil ou metil, por exemplo, podem ser ligados a essas lisinas, que são designadas K8, K12 e K16 de acordo com sua posição na cadeia proteica, como parte de modificações epigenéticas. Qual modificação química ocorre em qual posição da lisina é definitivamente de importância médica, como aponta o fisiologista de Freiburg. "A acetilação em K16, por exemplo, é importante para o desenvolvimento humano, enquanto a metilação em K12 desempenha um papel no desenvolvimento de alguns tumores de próstata e pulmão, de acordo com os últimos resultados do Centro Médico da Universidade de Freiburg".
Detecção de alterações com a ajuda de um nanopore Em seus experimentos, Behrends e sua equipe conseguiram distinguir claramente fragmentos H4 com ou sem acetilação, bem como fragmentos com uma, duas ou três acetilações. Além disso, eles conseguiram demonstrar que o nanoporo que eles usaram também era sensível ao local de acetilação:fragmentos de histonas com um grupo acetil em K8 bloquearam a corrente através do poro mais fortemente do que aqueles acetilados em K12, e estes, por sua vez, mais fortemente do que aqueles com uma acetilação K16.
"Esse tipo de sensibilidade é surpreendente, pois esses fragmentos são idênticos em termos de massa e volume total", diz Behrends. Assim, a corrente do poro parece ser sensível não apenas ao tamanho, mas também à forma da molécula. Foi igualmente fácil distinguir entre as diferentes variantes de fragmentos de histona duplamente acetilados - K8 e K12, K8 e K16 e K12 e K16 - novamente, apesar da massa idêntica. Os fragmentos H4 metilados em diferentes extensões e em diferentes posições também bloquearam a corrente através do poro em diferentes graus, embora não tão claramente quanto as variantes acetiladas.
"Conseguimos mostrar pela primeira vez através de nossos experimentos que a análise de nanoporos nos permite distinguir moléculas não apenas pelo tamanho, mas também pela forma", diz o líder do estudo, Behrends. Simulações de dinâmica molecular conduzidas pelo grupo de pesquisa liderado por Aleksei Aksimentiev, da Universidade de Illinois, nos EUA – também envolvidos no estudo – e mostram que um campo elétrico altamente não homogêneo dentro do poro desempenha um papel fundamental para esse efeito.
Visão de futuro:diagnóstico médico otimizado Enquanto o sequenciamento de DNA usando nanoporos já está estabelecido e comercializado, o desenvolvimento da análise de proteínas baseada em nanoporos está apenas começando, diz Behrends. "A dificuldade com proteínas de sequenciamento é que estas são moléculas com padrões de carga muito não uniformes." Enquanto o DNA, que é carregado negativamente, migra direcionalmente no campo elétrico e pode assim ser puxado através do poro base por base, as proteínas consistem em blocos de construção feitos de aminoácidos com cargas diferentes. Como resultado, o movimento direcionado no campo elétrico e a "varredura" de aminoácidos por aminoácidos não são possíveis. Os cientistas de Freiburg, portanto, confiaram em uma abordagem diferente para seus experimentos. Em vez de um poro com constrição curta, como usado no sequenciamento de DNA, eles usaram um poro feito sob medida com uma espécie de armadilha molecular. "Isso permitiu que todo o fragmento de proteína fosse capturado de uma só vez", diz Behrends.
Ainda não está claro até que tamanho de fragmento esse tipo de análise pode ser usado. No entanto, experimentos adicionais mostram que o método também será adequado para a análise dos fragmentos H4 usados anteriormente em pesquisas epigenéticas. Estes contêm 14 aminoácidos em vez dos dez usados aqui, e atualmente são investigados para modificações epigenéticas com espectrometria de massa em tandem, uma técnica altamente elaborada. Os pesquisadores esperam que os nanoporos tornem a análise muito mais simples, rápida e econômica, e que possa ser realizada próximo ao paciente.
O desenvolvimento da análise de nanoporos de proteínas para diagnóstico médico e sua implementação em produtos e serviços concretos também é um dos projetos centrais do recém-aprovado BMBF Cluster4Future nanodiagBW, que Behrends lidera junto com o Prof. Dr. Felix von Stetten da Hahn- Schickard-Gesellschaft, que é o líder deste projeto.
+ Explorar mais Os nanoporos podem identificar os aminoácidos nas proteínas, o primeiro passo para o sequenciamento
