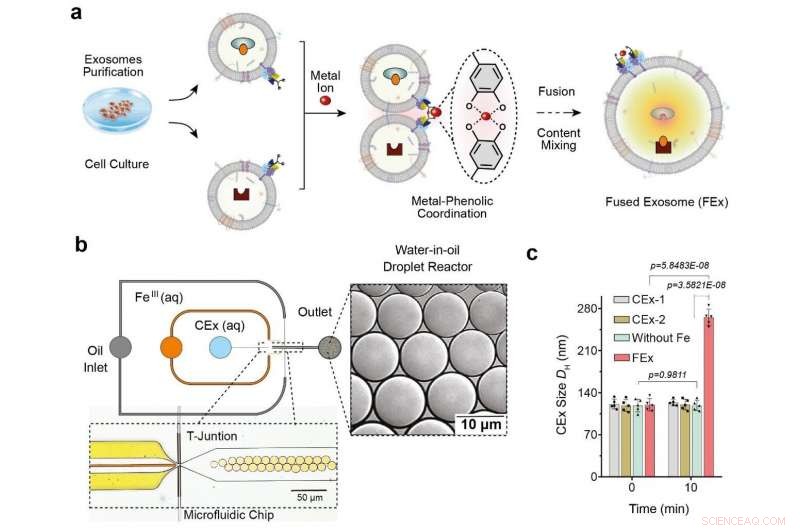
(a) O íon Fe3 + desencadeia a fusão da membrana em exossomos adaptados com catecol (CEx). A formação de um complexo metal-catecol aproxima os exossomos e permite a fusão. Diferentes reagentes em cada exossomo são então encapsulados juntos, promovendo a mistura e desencadeando reações dentro dos exossomos fundidos (FEx). (b) O dispositivo microfluídico projetado para gerar reatores de gotículas de água em óleo na junção de foco de fluxo. As duas fases aquosas (CEx e sal metálico) se encontram e são distribuídas na corrente de óleo (1% surfactante PFPE-PEG em FC-40) para quebrar o líquido em gotas. (c) Tamanho médio de exossomos não fundidos (CEx-1:121 ± 8 nm, CEx-2:123 ± 5 nm) e exossomos fundidos (FEx:265 ± 14 nm). Crédito:Institute for Basic Science
As células têm pequenos compartimentos conhecidos como organelas que realizam reações bioquímicas complexas. Esses compartimentos têm várias enzimas que trabalham juntas para executar funções celulares importantes. Pesquisadores do Center for Soft and Living Matter do Institute for Basic Science (IBS, Coreia do Sul) imitaram com sucesso esses compartimentos espaciais em nanoescala para criar "mitocôndrias artificiais". O estudo é publicado em Catálise Natural como um artigo de capa. Os pesquisadores afirmam que a tecnologia pode ser usada para construir organelas artificiais que podem fornecer ATP ou outras moléculas úteis às células em tecidos danificados ou doentes.
Isso foi conseguido através da reprogramação de exossomos, que são pequenas vesículas (diâmetro ~ 120 nm) que as células usam para sinalização intercelular. Os pesquisadores realizaram os experimentos usando reatores de gotículas microfluídicas, que gerou pequenas gotículas de tamanho semelhante às células típicas. (diâmetro ~ 10 μm) Os pesquisadores primeiro visaram facilitar a fusão controlada desses exossomos dentro das gotículas, evitando fusões indesejadas.
Eles conseguiram isso adaptando as superfícies do exossomo com moléculas chamadas catecol, que é um agente quelante que forma complexos com íons metálicos. Isso, por sua vez, foi feito anexando o catecol a anticorpos que têm como alvo marcadores celulares específicos, como o CD9. A propriedade de formação de complexos do catecol permite que eles conduzam fusões entre exossomos quando são misturados com íons metálicos como o Fe 3+ . A fusão da membrana ocorre quando os catecóis nas superfícies se ligam ao ferro e trazem as vesículas para perto umas das outras.
Os pesquisadores primeiro testaram a eficácia deste sistema carregando um tipo de exossomos com calceína-Co 2+ e outro com EDTA. Quando as duas vesículas se fundem e o conteúdo é misturado, EDTA pega o Co 2+ longe da calceína, que então permite que o último fique fluorescente. A equipe percebeu que teve sucesso na detecção do sinal de fluorescência, e a fusão foi posteriormente confirmada pela duplicação do diâmetro do exossomo medido.
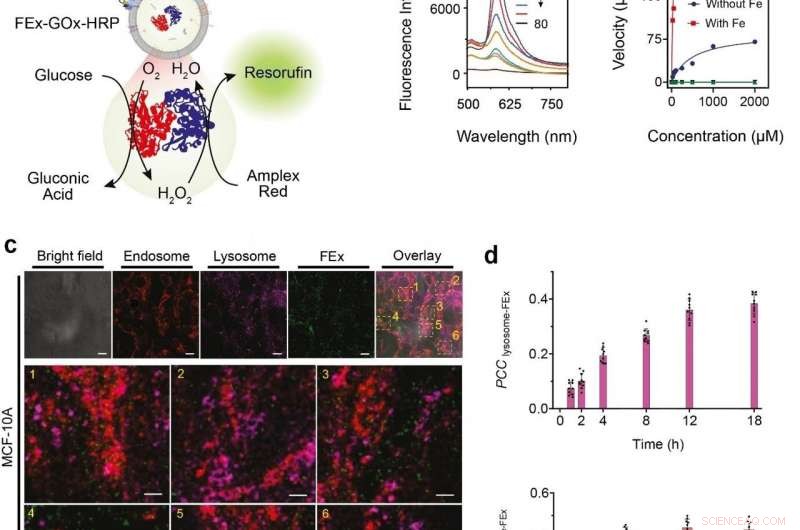
(a) Representação esquemática de uma fusão de duas enzimas GOx / HRP CEx em FEx. A reação catalítica foi iniciada pela adição de glicose, gerando H2O2 por oxidação aeróbia, que foi então usado para oxidar Amplex Red para gerar resorufina. (b) Espectros de fluorescência representativos de resorufina gerados por biocatálise em exossomos fundidos (FEx-GOx-HRP) em diferentes pontos de tempo. Taxa de reação para o nanorreator vs concentração de glicose para calcular constantes cinéticas pelo ajuste da equação de Michaelis-Menten. (c) Estabilidade e integridade de FEx-GOx-HRP após integração celular após 48 h. Endossomos (EEA1, vermelho) lisossomos (LAMP1, magenta), e FEx (verde) são mostrados. (d) Gráfico dos valores do coeficiente de correlação de Pearson (PCCLysosome-FEx) ao longo do tempo para fluorescência magenta (lisossoma) e verde (FEx), e para fluorescência vermelha (Endossomo) e verde (FEx). Crédito:Institute for Basic Science
Esses exossomos personalizados foram pré-carregados com diferentes reagentes e enzimas, que os transformou em nano fábricas biomiméticas. Isso permite que eles produzam biomoléculas de alto valor, realizando as transformações biocatalíticas desejadas de uma maneira espacialmente confinada, o que não é possível usando tubos de ensaio de laboratório convencionais. A equipe demonstrou a função da cascata biocatalítica multienzimática ao encapsular a glicose oxidase (GOx) e a peroxidase de rábano (HRP) dentro dos exossomos. O GOx primeiro converte a glicose em ácido glucônico e peróxido de hidrogênio. O HRP, por sua vez, usa o peróxido de hidrogênio gerado na primeira reação para oxidar Amplex Red a um produto fluorescente, resorufina. Os pesquisadores foram ainda capazes de dar um passo adiante ao adicionar uma terceira enzima, galactosidase que converte lactose em glicose, na mistura.
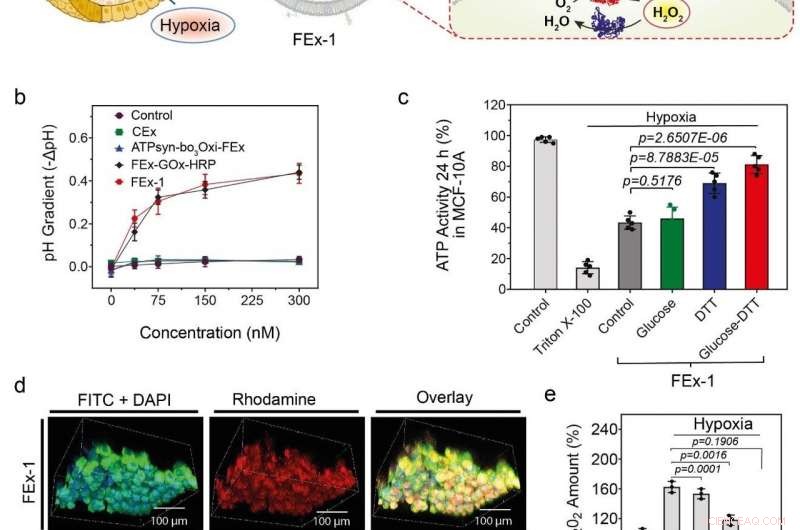
(a) Montagem de organelas artificiais para geração de energia. A ATP sintase foi reconstituída em CEx-GOx e bo3 oxidase foi reconstituída em CEx-HRP. Os dois CEx foram fundidos e foram capazes de penetrar profundamente nos esferóides. (b) Diminuição do pH (-ΔpH) vs. concentrações de glicose para diferentes exossomos. Os exossomos fundidos mostram um maior grau de diminuição do pH. (c) Mudanças na produção de ATP após a incorporação do FEx-1 sob diferentes condições. (d) Organelas artificiais foram capazes de penetrar profundamente no esferóide. A linha superior mostra FEx-1 (rotulado em vermelho com rodamina B), enquanto a linha inferior mostra a enzima HRP livre dentro dos esferóides. (e) Os níveis gerais de ROS diminuíram ao submeter FEx-1 sob glicose e DTT. Crédito:Institute for Basic Science
Próximo, os pesquisadores queriam saber exatamente o quão bem esses minirreatores podem ser captados e internalizados pelas células. As células derivadas de tecidos mamários humanos foram alimentadas com nanorreatores de exossomo fundido, e sua internalização nas 48 horas seguintes foi observada usando vários marcadores e um microscópio confocal de varredura a laser (CLSM). Verificou-se que as células foram capazes de captar esses exossomos personalizados principalmente por meio de endocitose, junto com vários outros mecanismos. Eles testaram ainda o sistema de duas enzimas GOx-HRP nas células, e descobriu-se que os exossomos fundidos eram capazes de fabricar produtos fluorescentes com sucesso, mesmo estando dentro das células.
Armado com este conhecimento, a equipe procurou criar mitocôndrias artificiais funcionais que fossem capazes de produzir energia dentro das células. Para alcançar isto, ATP sintase e bo 3 oxidase foram reconstituídas nos exossomos anteriores contendo GOx e HRP, respectivamente. Esses exossomos foram, por sua vez, fundidos para criar nanorreatores que podem produzir ATP usando glicose e ditiotreitol (DTT). Verificou-se que os exossomos fundidos eram capazes de penetrar profundamente na parte central de um tecido esferóide sólido e produzir ATP em seu ambiente hipóxico. As atividades dessas organelas simples foram acompanhadas por uma redução acentuada da geração de espécies reativas de oxigênio (ROS). Em contraste, enzimas livres foram incapazes de penetrar nesses esferóides de células compactados.
"Tomados em conjunto, nossos resultados destacam o potencial desses exossomos como nanorreatores na regulação da atividade metabólica das células dentro dos esferóides, e na atenuação do dano celular devido à hipóxia, "observa CHO Yoon-Kyoung, o autor correspondente do estudo. Espera-se que novas pesquisas em tais organelas artificiais apresentem um novo paradigma em vários campos, como diagnóstico e tratamento de doenças, biotecnologia, Medicina, e o meio ambiente.