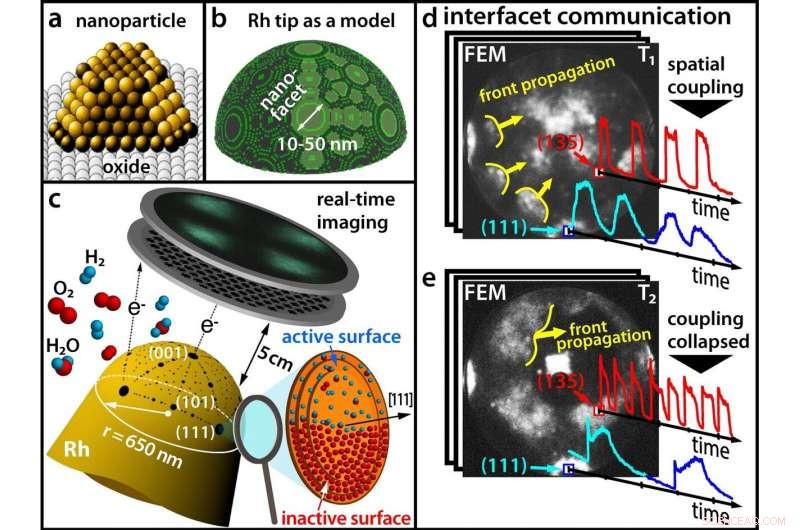
(a) Os catálogos modernos consistem em nanopartículas; (b) Uma ponta de ródio como modelo para uma nanopartícula; (c) Rastrear uma reação química em tempo real com um microscópio de emissão de campo (d) Em baixas temperaturas, facetas diferentes oscilam em sincronia (e) Em temperaturas mais altas, a sincronicidade é interrompida. Crédito:Universidade de Tecnologia de Viena
A maioria dos produtos químicos comerciais são produzidos com catalisadores. Usualmente, esses catalisadores consistem em minúsculas nanopartículas de metal colocadas em um suporte óxido. Semelhante a um diamante lapidado, cuja superfície consiste em facetas orientadas em diferentes direções, uma nanopartícula catalítica também possui facetas cristalograficamente diferentes - e essas facetas podem ter propriedades químicas diferentes.
Até agora, essas diferenças muitas vezes não foram consideradas na pesquisa de catálise porque é muito difícil obter simultaneamente informações sobre a própria reação química e sobre a estrutura da superfície do catalisador. Na TU Wien (Viena), isso agora foi alcançado pela combinação de diferentes métodos microscópicos:Com a ajuda da microscopia eletrônica de campo e da microscopia iônica de campo, tornou-se possível visualizar a oxidação do hidrogênio em uma única nanopartícula de ródio em tempo real com resolução nanométrica. Isso revelou efeitos surpreendentes que deverão ser levados em consideração na busca por melhores catalisadores no futuro. Os resultados já foram apresentados em revista científica Ciência .
O ritmo das reações químicas
"Em certas reações químicas, um catalisador pode alternar periodicamente para frente e para trás entre um estado ativo e inativo, "diz o Prof. Günther Rupprechter do Instituto de Química de Materiais da TU Wien." As oscilações químicas autossustentáveis podem ocorrer entre os dois estados - o químico Gerhard Ertl recebeu o Prêmio Nobel de Química por esta descoberta em 2007. "
Este também é o caso das nanopartículas de ródio, que são usados como um catalisador para a oxidação do hidrogênio - a base de cada célula de combustível. Sob certas condições, as nanopartículas podem oscilar entre um estado em que as moléculas de oxigênio se dissociam na superfície da partícula e um estado em que o hidrogênio está ligado.
O oxigênio incorporado muda o comportamento da superfície
"Quando uma partícula de ródio é exposta a uma atmosfera de oxigênio e hidrogênio, as moléculas de oxigênio são divididas em átomos individuais na superfície do ródio. Esses átomos de oxigênio podem então migrar abaixo da camada superior de ródio e se acumular como o oxigênio subterrâneo lá, "explica o Prof. Yuri Suchorski, o primeiro autor do estudo.
Por meio da interação com o hidrogênio, esses átomos de oxigênio armazenados podem ser retirados novamente e reagir com os átomos de hidrogênio. Então, novamente há espaço para mais átomos de oxigênio dentro da partícula de ródio e o ciclo começa novamente. "Este mecanismo de feedback controla a frequência das oscilações, "diz Yuri Suchorski.
Até agora, pensava-se que essas oscilações químicas sempre ocorriam de forma síncrona no mesmo ritmo em toda a nanopartícula. Afinal, os processos químicos nas diferentes facetas da superfície das nanopartículas estão espacialmente acoplados, já que os átomos de hidrogênio podem facilmente migrar de uma faceta para as facetas adjacentes.
Contudo, os resultados do grupo de pesquisa do Prof. Günther Rupprechter e do Prof. Yuri Suchorski mostram que as coisas são na verdade muito mais complexas:sob certas condições, o acoplamento espacial é levantado e facetas adjacentes de repente oscilam com frequências significativamente diferentes - e em algumas regiões da nanopartícula, essas "ondas químicas" oscilantes não se propagam de forma alguma.
"Isso pode ser explicado em escala atômica, "diz Yuri Suchorski." Sob a influência do oxigênio, fileiras salientes de átomos de ródio podem emergir de uma superfície lisa. "Essas fileiras de átomos podem então atuar como uma espécie de" quebra-onda "e impedir a migração de átomos de hidrogênio de uma faceta para outra - as facetas ficam desacopladas.
Se esse é o caso, as facetas individuais podem formar oscilações de frequências diferentes. "Em diferentes facetas, os átomos de ródio estão dispostos de forma diferente na superfície, "diz Günther Rupprechter." É por isso que a incorporação de oxigênio sob as diferentes facetas da partícula de ródio também ocorre em taxas diferentes, e assim oscilações com frequências diferentes resultam em facetas cristalograficamente diferentes. "
A hemisphere tip as a nanoparticle model
The key to unraveling this complex chemical behavior lays in using a fine rhodium tip as a model for a catalytic nanoparticle. An electric field is applied, and due to the quantum mechanical tunneling effect, electrons can leave the tip. These electrons are accelerated in the electric field and hit a screen, where a projection image of the tip is then created with a resolution of around 2 nanometers.
In contrast to scanning microscopies, where the surface sites are scanned one after the other, such parallel imaging visualizes all surface atoms simultaneously—otherwise it would not be possible to monitor the synchronization and desynchronization of the oscillations.
The new insights into the interaction of individual facets of a nanoparticle can now lead to more effective catalysts and provide deep atomic insights into mechanisms of non-linear reaction kinetics, pattern formation and spatial coupling.