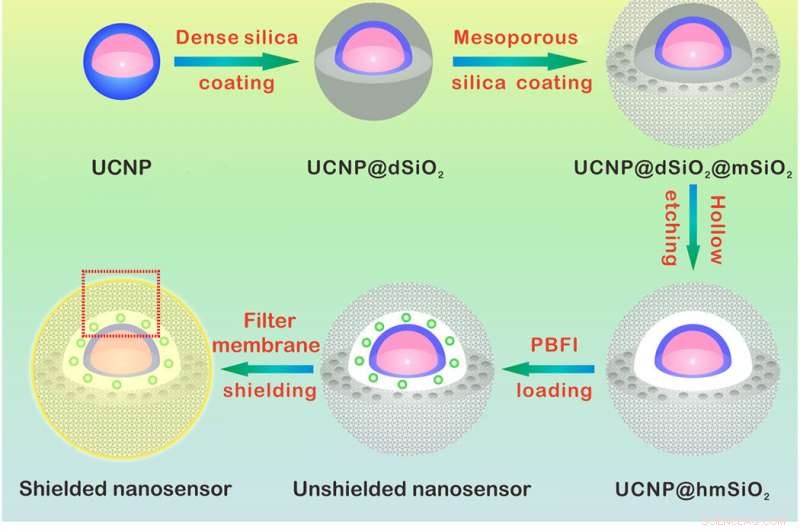
 p Projeto e mecanismo de detecção do nanossensor K +. (A) Ilustração esquemática para a síntese do nanossensor. O núcleo NaYF4:Yb / Tm @ NaYF4:Yb / Nd (UCNP) foi sintetizado e revestido com uma densa camada de sílica e uma sucessiva concha de sílica mesoporosa. A corrosão da camada densa de sílica forma uma cavidade oca que permite o carregamento de PBFI. O nanossensor foi finalmente revestido com a membrana de filtro seletiva de K +. (B) Esquemas mostrando uma visão ampliada do nanossensor [da caixa pontilhada vermelha em (A)] e seu mecanismo de detecção K +. A camada de membrana do filtro permite que apenas o K + se difunda para dentro e para fora do nanossensor, excluindo assim a interferência de outros cátions. Uma vez difundido no nanossensor, K + se ligará ao PBFI imediatamente. Após a irradiação NIR, a luz ultravioleta convertida dos UCNPs excita PBFI, levando à emissão de PBFI ligado a K +. Crédito:Science Advances, doi:10.1126 / sciadv.aax9757
p Projeto e mecanismo de detecção do nanossensor K +. (A) Ilustração esquemática para a síntese do nanossensor. O núcleo NaYF4:Yb / Tm @ NaYF4:Yb / Nd (UCNP) foi sintetizado e revestido com uma densa camada de sílica e uma sucessiva concha de sílica mesoporosa. A corrosão da camada densa de sílica forma uma cavidade oca que permite o carregamento de PBFI. O nanossensor foi finalmente revestido com a membrana de filtro seletiva de K +. (B) Esquemas mostrando uma visão ampliada do nanossensor [da caixa pontilhada vermelha em (A)] e seu mecanismo de detecção K +. A camada de membrana do filtro permite que apenas o K + se difunda para dentro e para fora do nanossensor, excluindo assim a interferência de outros cátions. Uma vez difundido no nanossensor, K + se ligará ao PBFI imediatamente. Após a irradiação NIR, a luz ultravioleta convertida dos UCNPs excita PBFI, levando à emissão de PBFI ligado a K +. Crédito:Science Advances, doi:10.1126 / sciadv.aax9757
p Os pesquisadores desenvolveram uma série de íons de potássio (K
+
) sondas para detectar K flutuante
+
concentrações durante uma variedade de processos biológicos. Contudo, tais sondas não são sensíveis o suficiente para detectar flutuações fisiológicas em animais vivos e não é fácil monitorar tecidos profundos com excitações de comprimento de onda curto que estão em uso até agora. Em um novo relatório, Jianan Liu e uma equipe de pesquisadores em neurociência, química, e engenharia molecular na China, descrevem um nanosensor altamente sensível e seletivo para infravermelho próximo (NIR) K
+
imagem de íons em células vivas e animais. A equipe construiu o nanosensor encapsulando nanopartículas de conversão ascendente (UCNPs) e um indicador de íon de potássio comercial na cavidade oca de nanopartículas de sílica mesoporosa e as revestiu com um K
+
membrana de filtro seletivo. A membrana adsorveu K
+
do meio e filtrados para longe de quaisquer cátions interferentes. Em seu mecanismo de ação, UCNPs converteu NIR em luz ultravioleta (UV) para excitar o indicador de íon potássio e detectar concentrações flutuantes de íon potássio em células cultivadas e em modelos animais de doença, incluindo camundongos e larvas de peixe-zebra. Os resultados agora são publicados em
Avanços da Ciência . p O potássio catiônico intracelular mais abundante (K
+
) é extremamente crucial em uma variedade de processos biológicos, incluindo a transmissão neural, batimento cardiaco, contração muscular e função renal. Variações no K intracelular ou extracelular
+
concentração (referida aqui como [K
+
]) sugerem funções fisiológicas anormais, incluindo disfunção cardíaca, Câncer, e diabetes. Como resultado, pesquisadores estão ansiosos para desenvolver estratégias eficazes para monitorar a dinâmica de [K
+
] flutuações, especificamente com imagem ótica direta.
p A maioria das sondas existentes não são sensíveis a K
+
detecção sob condições fisiológicas e não pode diferenciar flutuações entre [K
+
] e o íon de sódio acompanhante ([Na
+
]) durante o transporte transmembrana no Na
+
/ K
+
bombas. Enquanto a imagem de fluorescência pode distinguir K
+
e Na
+
em solução de água, o método requer instrumentos especializados. Mais K
+
os sensores também são ativados com luz de comprimento de onda curto, incluindo ultravioleta (UV) ou luz visível - levando a uma dispersão significativa e profundidade de penetração limitada ao examinar tecidos vivos. Em contraste, a técnica de imagem de infravermelho próximo (NIR) proposta oferecerá vantagens exclusivas durante a imagem de tecido profundo como uma alternativa plausível.
p
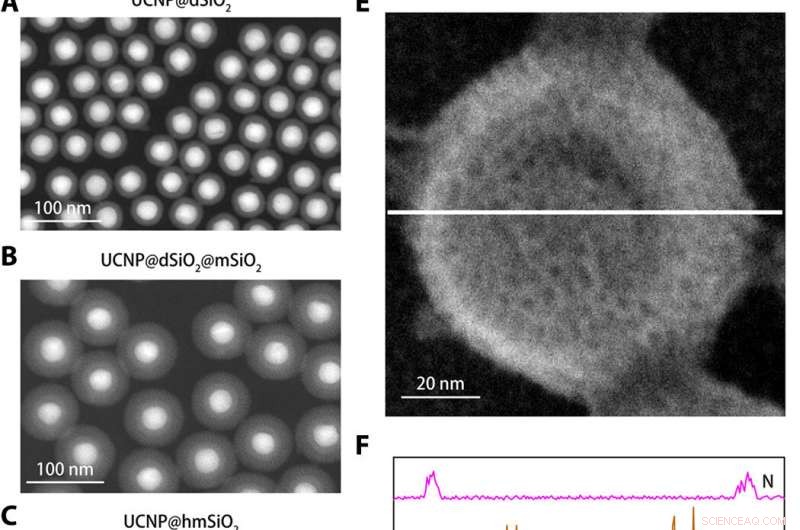 p Caracterização estrutural do nanossensor K +. (A a C) Imagens anulares de campo escuro de alto ângulo de UCNP @ dSiO2 (A), UCNP @ dSiO2 @ mSiO2 (B), e UCNP @ hmSiO2 (C). (D) Imagem de microscopia eletrônica de varredura (SEM) do nanosensor blindado. (E) Imagem SEM do nanossensor protegido imerso em uma solução aquosa contendo 150 mM de Na +, 150 mM K +, 2 mM Ca2 +, 2 mM Mg2 +, 50 μM Fe2 +, 2 mM Zn2 +, 50 μM Mn2 +, e 50 μM Cu2 +. (F) Os perfis de varredura da linha elementar EDS ao longo da linha branca em (E) revelam que apenas os sinais de K + estão presentes nos mesoporos e cavidades ocas dos nanosensores blindados. Crédito:Science Advances, doi:10.1126 / sciadv.aax9757
Projetando o K
+
nanossensor e caracterizando sua estrutura
p Caracterização estrutural do nanossensor K +. (A a C) Imagens anulares de campo escuro de alto ângulo de UCNP @ dSiO2 (A), UCNP @ dSiO2 @ mSiO2 (B), e UCNP @ hmSiO2 (C). (D) Imagem de microscopia eletrônica de varredura (SEM) do nanosensor blindado. (E) Imagem SEM do nanossensor protegido imerso em uma solução aquosa contendo 150 mM de Na +, 150 mM K +, 2 mM Ca2 +, 2 mM Mg2 +, 50 μM Fe2 +, 2 mM Zn2 +, 50 μM Mn2 +, e 50 μM Cu2 +. (F) Os perfis de varredura da linha elementar EDS ao longo da linha branca em (E) revelam que apenas os sinais de K + estão presentes nos mesoporos e cavidades ocas dos nanosensores blindados. Crédito:Science Advances, doi:10.1126 / sciadv.aax9757
Projetando o K
+
nanossensor e caracterizando sua estrutura
p Para projetar o nanosensor, Liu et al. nanopartículas de conversão ascendente encapsuladas (UCNPs) e um K comercial
+
indicador - isoftalato de benzofurano de ligação de potássio (PBFI) no núcleo de nanopartículas de sílica mesoporosa (MSNs). Os UCNPs foram capazes de converter a luz NIR em luz ultravioleta e excitar o aceitador do K
+
indicador através da transferência de energia de ressonância luminescente. Eles protegeram a superfície externa das nanopartículas de sílica com uma fina camada de K
+
membrana de filtro seletivo com microporos criados a partir de oxigênio carbonil para especificidade. A configuração favoreceu a transferência livre de K
+
através do poro da membrana, enquanto evita que outros cátions biologicamente relevantes se difundam. A técnica permitiu-lhes detectar ligeiras flutuações em [K
+
] na solução. A equipe usou microscopia eletrônica de transmissão (TEM) para observar a estrutura bem controlada e a aparência das nanopartículas durante cada etapa da construção do nanosensor. O espalhamento de luz dinâmico confirmou a presença de uma membrana de filtro na superfície do nanossensor blindado.
p
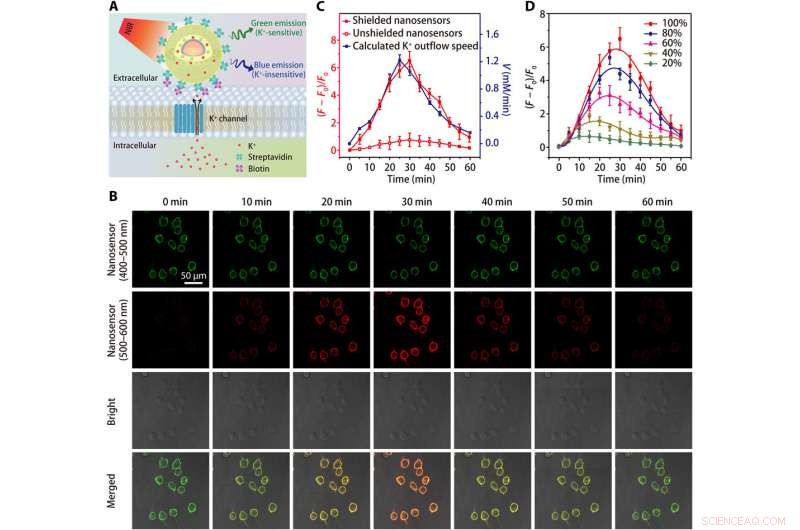 p Imagem de efluxo de K + em células HEK 293. (A) Esquemas mostrando a detecção de efluxo de K + por um nanosensor conjugado com estreptavidina, que é amarrado a uma célula modificada com biotina. (B) Imagens de microscopia confocal mostrando a fluorescência (em 400 a 500 nm e 500 a 600 nm) de células HEK 293 marcadas com nanosensor em diferentes pontos de tempo após o tratamento com o estimulador de efluxo K + (uma mistura de nigericina 5 μM, 5 μM de bumetanida, e ouabaína 10 μM). (C) Cursos de tempo de variações de fluorescência de nanossensor e dependência de tempo calculada da taxa de efluxo de K + após o tratamento com estimulador de efluxo de K +. (D) Flutuações de fluorescência dependentes do tempo de células HEK 293 marcadas com nanosensor blindadas após tratamentos com diferentes concentrações (20, 40, 60, 80, e 100%) de estimulador de efluxo de K +. Os resultados de cinco experiências independentes foram resumidos como média ± SEM em (C) e (D). Crédito:Science Advances, doi:10.1126 / sciadv.aax9757
Desempenho do nanossensor na água e durante [K
+
] flutuações nas células.
p Imagem de efluxo de K + em células HEK 293. (A) Esquemas mostrando a detecção de efluxo de K + por um nanosensor conjugado com estreptavidina, que é amarrado a uma célula modificada com biotina. (B) Imagens de microscopia confocal mostrando a fluorescência (em 400 a 500 nm e 500 a 600 nm) de células HEK 293 marcadas com nanosensor em diferentes pontos de tempo após o tratamento com o estimulador de efluxo K + (uma mistura de nigericina 5 μM, 5 μM de bumetanida, e ouabaína 10 μM). (C) Cursos de tempo de variações de fluorescência de nanossensor e dependência de tempo calculada da taxa de efluxo de K + após o tratamento com estimulador de efluxo de K +. (D) Flutuações de fluorescência dependentes do tempo de células HEK 293 marcadas com nanosensor blindadas após tratamentos com diferentes concentrações (20, 40, 60, 80, e 100%) de estimulador de efluxo de K +. Os resultados de cinco experiências independentes foram resumidos como média ± SEM em (C) e (D). Crédito:Science Advances, doi:10.1126 / sciadv.aax9757
Desempenho do nanossensor na água e durante [K
+
] flutuações nas células.
p A equipe testou a sensibilidade aprimorada do nanossensor blindado em uma faixa fisiológica (0 a 150 mM) e mostrou um aumento de 12 vezes na intensidade de fluorescência em comparação com os nanossensores não blindados. O K
+
sondas tiveram que exibir alta seletividade contra Na
+
, em que Liu et al. verificado usando o nanosensor protegido detectando rapidamente a sensibilidade de fluorescência consistente para [K
+
], enquanto permanece inalterado pelo aumento de [Na
+
]
p Uma vez que as células vivas dependem da adenosina trifosfatase sódio-potássio (Na
+
/ K
+
bomba) para manter uma inclinação [K
+
] gradiente através de sua membrana plasmática, o processo é parcialmente responsável pelo gasto de energia da célula. Defeitos no metabolismo da energia celular podem levar a uma perda de [K
+
] gradiente, ao dar origem a extracelular [K
+
] conhecido como [K
+
]
0, que os cientistas monitoraram para obter um indicador valioso de viabilidade e crescimento celular. Depois disso, eles aumentaram a especificidade do nanossensor para detectar morte celular ou taxas de proliferação enxertando polietilenoglicol (PEG) na superfície dos nanossensores em um meio de cultura contendo a linha celular 293 de rim embrionário humano. Eles então otimizaram o protocolo ancorando um grande número de nanosensores em membranas celulares usando nanosensores conjugados com estreptavidina a células modificadas com biotina. Os resultados destacaram a sensibilidade aprimorada de nanosensores blindados para monitorar continuamente o K
+
efluxo.
p
 p Resultados de imagem K + do cérebro de camundongo tratado com nanosensores protegidos após o início da depressão de propagação pelo disparo de KCl. O vídeo completo é oito vezes mais rápido do que a velocidade real. Crédito:Science Advances, doi:10.1126 / sciadv.aax9757
Espalhando ondas no cérebro intacto do camundongo
p Resultados de imagem K + do cérebro de camundongo tratado com nanosensores protegidos após o início da depressão de propagação pelo disparo de KCl. O vídeo completo é oito vezes mais rápido do que a velocidade real. Crédito:Science Advances, doi:10.1126 / sciadv.aax9757
Espalhando ondas no cérebro intacto do camundongo
p A equipe então aplicou o nanosensor blindado para investigar a depressão alastrante cortical (CSD) no cérebro do camundongo como uma propagação da atividade neural em forma de onda. O processo normalmente envolve uma liberação de propagação lenta de K
+
na superfície cortical e pode ser desencadeada no cérebro do camundongo por meio da incubação de cloreto de potássio (KCl). Os cientistas monitoraram simultaneamente o potencial de campo local e o sinal óptico através da janela craniana cirúrgica e observaram uma onda de aumento de [K
+
]
0 propagam-se gradualmente através do córtex após a estimulação. Liu et al. não observaram uma onda em camundongos injetados com nanossensores não blindados, indicando a importância do filtro externo para melhorar a sensibilidade do nanossensor. A velocidade da onda registrada não variou significativamente dos valores obtidos usando ressonância magnética dependente do nível de oxigênio do sangue (MRI) em pacientes com aura de enxaqueca.
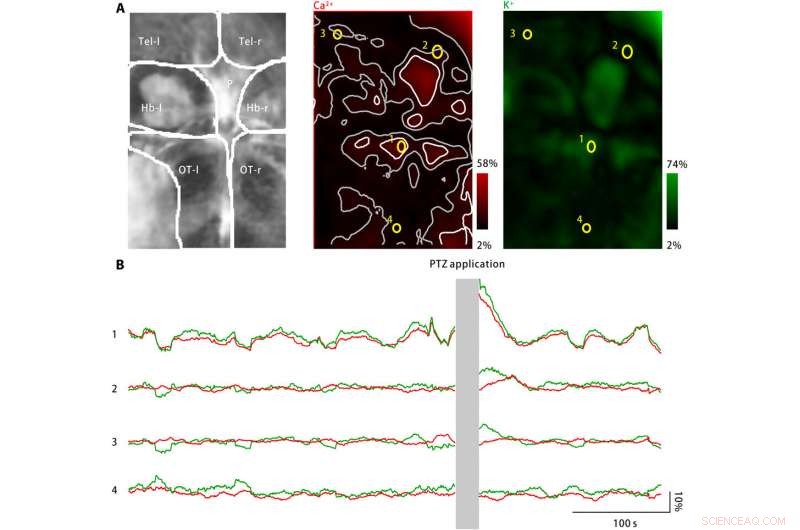 p O potássio extracelular estourou no cérebro do peixe-zebra larval após o tratamento com PTZ. (A) O tratamento com PTZ induziu aumentos na atividade neuronal do cálcio (meio) e na concentração extracelular de potássio (direita). Esquerda:as áreas do cérebro com imagens incluem o telencephala esquerdo e direito (Tel-l e Tel-r, respectivamente), as habenulas esquerda e direita (Hb-l e Hb-r, respectivamente), o corpo pineal (P), e o tecta óptico esquerdo e direito (OT-l e OT-r, respectivamente). Meio:a atividade do cálcio neuronal foi monitorada usando um indicador de cálcio expresso geneticamente, jRGECO1a. A amplitude de resposta medida é codificada em vermelho e mapeada de volta para a região do cérebro com imagem. Pontos de atividade dispersos são marcados em branco, e suas zonas vizinhas são marcadas em cinza. Quatro ROIs (amarelo) são selecionadas. Direita:A concentração extracelular de potássio foi monitorada usando o nanossensor de potássio. A amplitude de resposta medida é codificada em verde e mapeada de volta para a região do cérebro com imagem. (B) A atividade neuronal de cálcio (vermelho) e as concentrações extracelulares de potássio observadas para as quatro ROIs representativas estão marcadas em (A). Após a aplicação PTZ, tanto a atividade de cálcio neuronal quanto a concentração de potássio extracelular aumentaram em vários pontos de atividade, incluindo o corpo pineal e a tecta óptica anterior, conforme representado por ROI1. Nas zonas vizinhas dos pontos de atividade, a alteração da atividade do cálcio neuronal está ausente ou é mínima, enquanto a concentração extracelular de potássio continua a aumentar (ROI2 e ROI3). Contudo, na área longe dos pontos de atividade (ROI4), nem a atividade neuronal do cálcio nem a concentração extracelular de potássio aumentaram. Crédito:Science Advances, doi:10.1126 / sciadv.aax9757
p O potássio extracelular estourou no cérebro do peixe-zebra larval após o tratamento com PTZ. (A) O tratamento com PTZ induziu aumentos na atividade neuronal do cálcio (meio) e na concentração extracelular de potássio (direita). Esquerda:as áreas do cérebro com imagens incluem o telencephala esquerdo e direito (Tel-l e Tel-r, respectivamente), as habenulas esquerda e direita (Hb-l e Hb-r, respectivamente), o corpo pineal (P), e o tecta óptico esquerdo e direito (OT-l e OT-r, respectivamente). Meio:a atividade do cálcio neuronal foi monitorada usando um indicador de cálcio expresso geneticamente, jRGECO1a. A amplitude de resposta medida é codificada em vermelho e mapeada de volta para a região do cérebro com imagem. Pontos de atividade dispersos são marcados em branco, e suas zonas vizinhas são marcadas em cinza. Quatro ROIs (amarelo) são selecionadas. Direita:A concentração extracelular de potássio foi monitorada usando o nanossensor de potássio. A amplitude de resposta medida é codificada em verde e mapeada de volta para a região do cérebro com imagem. (B) A atividade neuronal de cálcio (vermelho) e as concentrações extracelulares de potássio observadas para as quatro ROIs representativas estão marcadas em (A). Após a aplicação PTZ, tanto a atividade de cálcio neuronal quanto a concentração de potássio extracelular aumentaram em vários pontos de atividade, incluindo o corpo pineal e a tecta óptica anterior, conforme representado por ROI1. Nas zonas vizinhas dos pontos de atividade, a alteração da atividade do cálcio neuronal está ausente ou é mínima, enquanto a concentração extracelular de potássio continua a aumentar (ROI2 e ROI3). Contudo, na área longe dos pontos de atividade (ROI4), nem a atividade neuronal do cálcio nem a concentração extracelular de potássio aumentaram. Crédito:Science Advances, doi:10.1126 / sciadv.aax9757
p Para estender as aplicações do nanosensor, Liu et al. monitorou os níveis de cálcio neuronal e as concentrações extracelulares de potássio usando larvas de peixe-zebra. Embora um grande aumento na concentração de potássio extracelular possa causar intensa ativação neuronal para causar CSD e epilepsia, não existe evidência direta para mostrar mudanças no potássio extracelular durante a doença. A equipe, portanto, projetou um modelo de doença usando larvas de peixe-zebra para aumentar as concentrações extracelulares de potássio e observou a ativação neuronal característica da doença em regiões específicas do cérebro.
p Desta maneira, Jianan Liu e seus colegas projetaram um nanossensor de íon de potássio com sensibilidade e seletividade extremamente altas. O revestimento externo de uma membrana de filtro seletiva aumentou a seletividade, sensibilidade, e cinética do dispositivo para rápida e quantitativa [K
+
] detecção em células vivas e cérebros intactos. O nanosensor blindado terá amplas aplicações na pesquisa do cérebro para melhorar a compreensão de [K
+
doenças relacionadas com]. O método, juntamente com endoscópio baseado em fibra óptica e fotometria, permitirá imagens de potássio em tempo real em animais que se movem livremente. p © 2020 Science X Network




