Nano girassóis de ouro-DNA para silenciamento de genes eficiente e transformação controlada
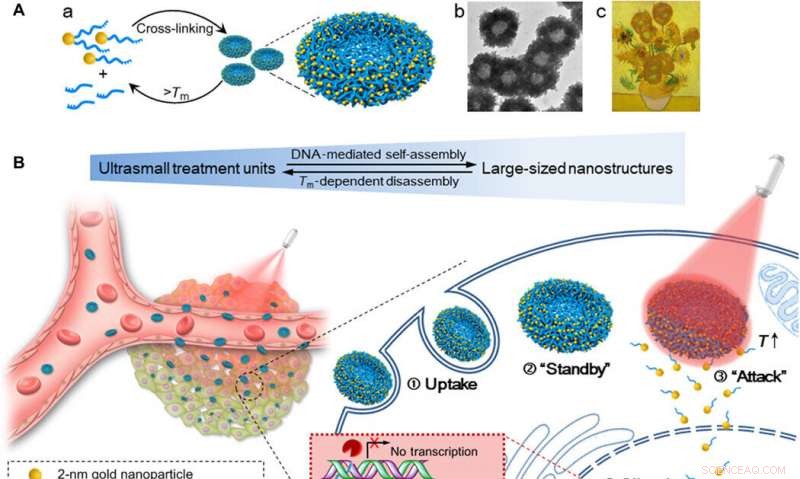 p Esquema de nano girassóis de ouro-DNA automontados para aumentar a quantidade de absorção celular, eficácia de silenciamento de gene ajustável, e efeito de inibição do tumor controlado por irradiação NIR. (A) (a) Montagem e desmontagem da nanoestrutura de grande porte (nano girassóis de ouro-DNA de 200 nm) de / para nanopartículas ultrapequenas (NPs de Au-POY2T de 2 nm). (b) Imagem TEM representativa dos nano girassóis. (c) Obra-prima:Girassóis (Vincent van Gogh, 1889). (B) Esquerda:Retenção tumoral in vivo e penetração de nano girassóis transformáveis. Direita:Captação celular aumentada e processo de silenciamento de oncogene controlado dos nano girassóis in vitro. ① Nano girassóis de grande porte foram capturados por uma célula MCF-7. ② Os nano girassóis ficam em espera no citoplasma da célula. ③ Após a irradiação NIR, nanoestruturas de ouro-DNA de grande porte se dissociam e liberam pequenas unidades (NPs Au-POY2T de 2 nm) para atacar o núcleo da célula. ④ A sequência de silenciamento POY2T se ligará ao promotor P2 do oncogene c-myc e regulará negativamente a expressão de c-myc de células MCF-7, que pode ser controlada (ON / OFF) e regulada (Low / Medium / High) pela irradiação NIR. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aaw6264
p Esquema de nano girassóis de ouro-DNA automontados para aumentar a quantidade de absorção celular, eficácia de silenciamento de gene ajustável, e efeito de inibição do tumor controlado por irradiação NIR. (A) (a) Montagem e desmontagem da nanoestrutura de grande porte (nano girassóis de ouro-DNA de 200 nm) de / para nanopartículas ultrapequenas (NPs de Au-POY2T de 2 nm). (b) Imagem TEM representativa dos nano girassóis. (c) Obra-prima:Girassóis (Vincent van Gogh, 1889). (B) Esquerda:Retenção tumoral in vivo e penetração de nano girassóis transformáveis. Direita:Captação celular aumentada e processo de silenciamento de oncogene controlado dos nano girassóis in vitro. ① Nano girassóis de grande porte foram capturados por uma célula MCF-7. ② Os nano girassóis ficam em espera no citoplasma da célula. ③ Após a irradiação NIR, nanoestruturas de ouro-DNA de grande porte se dissociam e liberam pequenas unidades (NPs Au-POY2T de 2 nm) para atacar o núcleo da célula. ④ A sequência de silenciamento POY2T se ligará ao promotor P2 do oncogene c-myc e regulará negativamente a expressão de c-myc de células MCF-7, que pode ser controlada (ON / OFF) e regulada (Low / Medium / High) pela irradiação NIR. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aaw6264
p O desenvolvimento de um sistema de entrega eficiente para terapias baseadas em interferência de genes aprimoradas e controladas é um desafio existente na biologia molecular. O avanço do campo da nanotecnologia pode fornecer uma solução eficaz, estratégia interdisciplinar para facilitar a entrega de ácido nucleico. Em um novo relatório, Shuaidong Huo e colegas dos departamentos interdisciplinares de Nanociência, Materiais Interativos, Química e Pesquisa de Polímeros na China, A Alemanha e os EUA usaram sequências de oligonucleotídeos formadoras de triplex acopladas à sua fita complementar para mediar a automontagem de nanopartículas de ouro ultrapequenas. p As nanoestruturas semelhantes ao girassol resultantes mostraram forte absorção no infravermelho próximo (NIR) e capacidade de conversão fototérmica. Quando os cientistas irradiaram as estruturas com NIR, as nanoestruturas maiores desmontadas para gerar nanopartículas ultrapequenas modificadas com a sequência do oncogene c-Myc para atingir diretamente o núcleo da célula cancerosa. Huo et al. silenciamento de genes controlados por meio do controle sinérgico do tempo de pré-incubação das células com nanopartículas junto com a automontagem da nanoestrutura (in vitro e in vivo) e o período de irradiação NIR. O estudo forneceu um novo paradigma para a construção de nanocarreadores eficientes e personalizados para aplicações de interferência gênica e entrega de genes terapêuticos.
p A terapia genética tem grande potencial para tratar uma variedade de doenças e complicações, incluindo infertilidade, HIV e câncer. A terapia gênica bem-sucedida para aliviar os sintomas da doença depende de um veículo ou vetor de entrega de genes eficiente. Durante o processo, o portador do gene deve cruzar muitas barreiras biológicas e membranas celulares enquanto escapa do aprisionamento endossomal e da degradação baseada em nuclease. Em comparação com as estratégias de entrega baseadas em vírus, abordagens de entrega de genes não virais enfrentam muitos desafios durante o processo de carregamento e liberação de DNA / RNA, entrega direcionada e captação intracelular, incluindo incompatibilidade em relação às respostas imunes in vivo.
p Esforços vigorosos em nanotecnologia estão em andamento para projetar veículos estáveis e eficientes para a transferência de genes para células cancerosas. Devido às suas propriedades físico-químicas únicas, vários nanomateriais surgiram para a entrega de genes. Entre eles, nanopartículas de ouro (Au NPs) com tamanho específico e propriedades de superfície podem superar obstáculos in vivo para se tornar um dos sistemas portadores de genes mais estudados. Contudo, essas estratégias encontraram uma variedade de deficiências e, portanto, é importante estabelecer sistemas de entrega eficientes ou terapias genéticas aprimoradas e controladas.
p
Auto-montagem e teste de nanoestruturas semelhantes a girassol
p No presente trabalho, Huo et al. foram inspirados pela capacidade da natureza de hibridizar DNA por engenharia mediada por DNA, nanoestruturas de DNA de ouro auto-organizadas (aproximadamente 200 nm). O desenho tipo girassol mostrou forte absorção de NIR e propriedades de conversão fototérmica. Após a irradiação NIR, as estruturas desmontadas para liberar nanopartículas de ouro ultrapequenas (2 nm, Au NPs) com potencial para silenciamento de oncogene, melhorou a permeabilidade das células e núcleos e aumentou a eficiência de transfecção. Os cientistas controlaram sinergicamente as interações célula-nanomaterial com base no tempo de pré-incubação no laboratório, seguido pelo tempo de circulação in vivo e o cronograma de irradiação. Os experimentos facilitaram o aumento da captação celular, eficácia de silenciamento de gene ajustável e inibição de tumor controlada. Os nano girassóis transformáveis forneceram um excelente modelo para projetar nanoveículos para entrega de drogas com grande potencial na biomedicina.
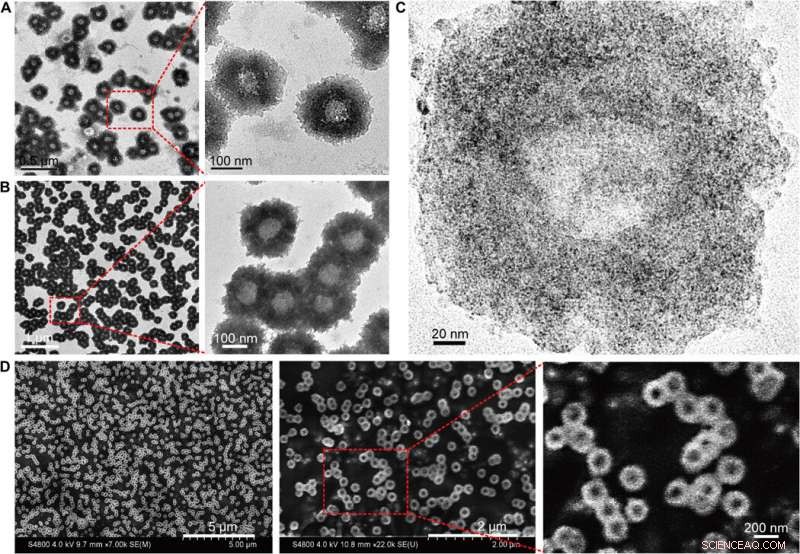 p Caracterização morfológica de nanoestruturas automontadas (nano girassóis). (A) Imagens TEM (200 kV) dos nano girassóis com detalhes estruturais aumentados. (B) Imagens de Bio-TEM (80 kV) com detalhes estruturais de polímero ampliados. (C) Imagens TEM de alta resolução (200 kV) mostrando a distribuição de NPs ultra-pequenos na nanoestrutura automontada. (D) Imagens SEM com topografia de superfície ampliada dos nano girassóis. Crédito:Science Advances, doi:10.1126 / sciadv.aaw6264
p Caracterização morfológica de nanoestruturas automontadas (nano girassóis). (A) Imagens TEM (200 kV) dos nano girassóis com detalhes estruturais aumentados. (B) Imagens de Bio-TEM (80 kV) com detalhes estruturais de polímero ampliados. (C) Imagens TEM de alta resolução (200 kV) mostrando a distribuição de NPs ultra-pequenos na nanoestrutura automontada. (D) Imagens SEM com topografia de superfície ampliada dos nano girassóis. Crédito:Science Advances, doi:10.1126 / sciadv.aaw6264
p Huo et al. primeiro sintetizou os NPs de Au de dois nanômetros revestidos com tiopronina e os modificou com tiol-oligonucleotídeos (SH-POY2T) usando um método estabelecido de troca de ligante. O oligonucleotídeo POY2T de 23 nucleotídeos (nt) ligou-se ao promotor P2 do oncogene c-myc para formar uma estrutura triplex e regular negativamente a expressão oncogênica de c-myc. Em paralelo, eles projetaram e sintetizaram outra sequência de fita simples conhecida como CA para hibridizar complementarmente à cauda da sequência POY2T e bloquear sua ligação ao oncogene c-myc. Na conclusão, a nanoestrutura se auto-montou em estruturas semelhantes às do girassol. A equipe investigou a nanoestrutura (200 nm) usando microscopia eletrônica de transmissão (TEM). Imagens adicionais revelaram mais detalhes das porções de DNA da estrutura do "girassol". Quando os cientistas de materiais usaram microscopia eletrônica de varredura (SEM) para validar os resultados de TEM, observaram consistência entre os métodos.
p Eles investigaram os espectros de absorção de UV-Vis dos ultrasmall Au NPs antes da automontagem mediada por DNA. O monodisperso, NPs individuais de Au-POY2T de dois nanômetros mostraram forte absorção na região NIR para gerar calor sob irradiação NIR. Huo et al. creditaram a forte absorvância NIR observada para fechar o espaçamento entre as partículas e distribuição espacial não uniforme de NPs individuais dentro da nanoestrutura maior. Eles testaram a resposta ao calor das nanoestruturas automontadas sob irradiação NIR e observaram o ponto de fusão das sequências de DNA complementares (POY2T e CA) em aproximadamente 41 graus C, dissociando metade da estrutura duplex entre sequências de DNA complementares. Huo et al. selecionou 10 minutos como o tempo ideal para a irradiação NIR no estudo.
p
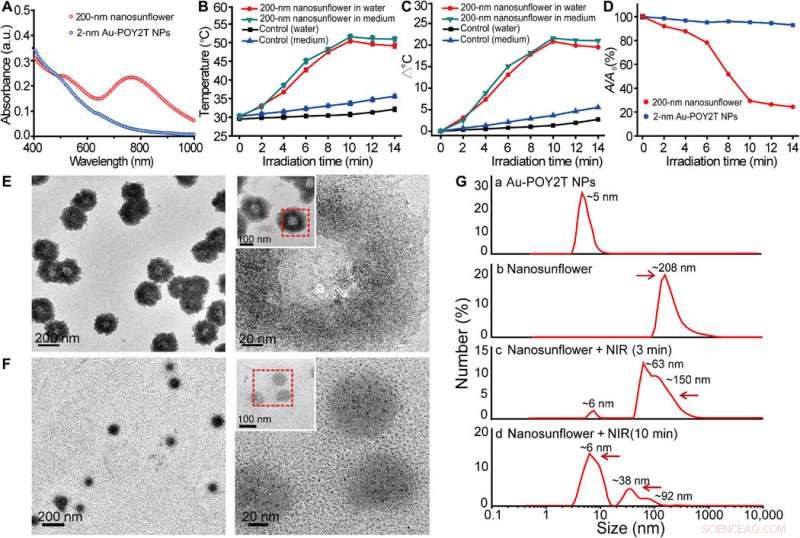 p Propriedade fototérmica e estudo do comportamento de desmontagem de nanoestruturas automontadas. (A) Espectro de absorção visível de NPs com tamanho de núcleo de 2 nm e nanoestruturas automontadas de 200 nm. a.u., unidade de absorbância. (B) Resposta à temperatura de nanoestruturas automontadas, após a irradiação NIR, disperso em água e meio de cultura de células. Valores médios ± SD, n =3. (C) Aumento de temperatura de nanoestruturas automontadas, após a irradiação NIR, disperso em água e meio de cultura de células. (D) Mudança de absorbância máxima (767 nm) de NPs de tamanho de núcleo de 2 nm e nanoestruturas automontadas de 200 nm após irradiação de NIR. (E e F) observação TEM do comportamento de desmontagem de nanoestruturas automontadas de 200 nm antes (superior) e após (inferior) irradiação NIR (808 nm, 10 min). (G) Diâmetro hidrodinâmico de (a) NPs Au-POY2T monodispersos de 2 nm e mudança de tamanho dos nano girassóis de 200 nm antes (b) e após (c e d) a irradiação NIR por diferentes períodos de tempo (3 e 10 min). Crédito:Science Advances, doi:10.1126 / sciadv.aaw6264
Comportamento de desmontagem das nanoestruturas automontadas e prova de conceito
p Propriedade fototérmica e estudo do comportamento de desmontagem de nanoestruturas automontadas. (A) Espectro de absorção visível de NPs com tamanho de núcleo de 2 nm e nanoestruturas automontadas de 200 nm. a.u., unidade de absorbância. (B) Resposta à temperatura de nanoestruturas automontadas, após a irradiação NIR, disperso em água e meio de cultura de células. Valores médios ± SD, n =3. (C) Aumento de temperatura de nanoestruturas automontadas, após a irradiação NIR, disperso em água e meio de cultura de células. (D) Mudança de absorbância máxima (767 nm) de NPs de tamanho de núcleo de 2 nm e nanoestruturas automontadas de 200 nm após irradiação de NIR. (E e F) observação TEM do comportamento de desmontagem de nanoestruturas automontadas de 200 nm antes (superior) e após (inferior) irradiação NIR (808 nm, 10 min). (G) Diâmetro hidrodinâmico de (a) NPs Au-POY2T monodispersos de 2 nm e mudança de tamanho dos nano girassóis de 200 nm antes (b) e após (c e d) a irradiação NIR por diferentes períodos de tempo (3 e 10 min). Crédito:Science Advances, doi:10.1126 / sciadv.aaw6264
Comportamento de desmontagem das nanoestruturas automontadas e prova de conceito
p Os cientistas levantaram a hipótese de que as nanoestruturas automontadas encolheriam e se desmontariam em NPs individuais de Au-POY2T ultra-pequenos. Após 10 minutos de irradiação NIR, a absorção máxima (767 nm) de nanoestruturas diminuiu acentuadamente para desmontar a estrutura do girassol. Eles seguiram os experimentos antes e depois da irradiação NIR com observações TEM e usaram analisadores de tamanho de partícula para entender o processo de desmontagem e transformação de tamanho das nanoestruturas de até seis nanômetros de tamanho e confirmaram a adequação ideal do cronograma de 10 minutos.
p Huo et al. aplicou irradiação NIR a células MCF-7 tratadas com nanoestruturas de DNA de ouro automontadas e testou sua captação celular in vitro como prova de conceito. Eles determinaram a internalização celular de Au-POY2T (2 nm) em diversos tempos de incubação e quantificaram sua captação celular usando espectroscopia de massa de plasma acoplado indutivamente (ICP-MS) e métodos anteriores. Eles notaram um aumento da internalização após seis horas de incubação em comparação com os cronogramas de incubação de 24 horas. Eles não observaram inibidores de endocitose para influenciar a captação de NP de Au-POY2T, sugerindo o envolvimento de um caminho alternativo, como a fusão da membrana.
p
Compreendendo o comportamento de silenciamento de genes das nanoestruturas automontadas
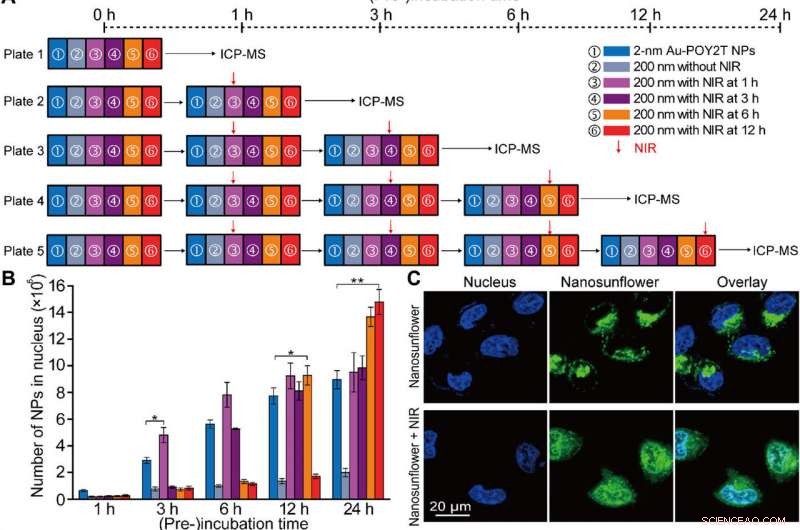 p Localização controlada de núcleos e estudo de silenciamento gênico in vitro de nanoestruturas automontadas. (A) Esquema da configuração experimental da célula in vitro para a localização controlada do núcleo NP e estudo da regulação do gene. (B) Número de NPs Au-POY2T de 2 nm localizados no núcleo da célula MCF-7 com tratamento de ① NPs Au-POY2T individuais de 2 nm, ② nano girassóis de 200 nm, e nano girassóis de 200 nm com irradiação NIR (10 min) após diferentes tempos de pré-incubação (③ 1, ④ 3, ⑤ 6, e ⑥ 12 horas). Valores médios ± SD, n =3. As diferenças estatísticas foram determinadas pelo teste t de Student bicaudal; * P <0,05 e ** P <0,01. (C) Observação confocal da distribuição de nano girassóis marcados com isotiocianato de fluoresceína (verde) antes (topo) e depois (parte inferior) da irradiação NIR em células MCF-7. O núcleo foi marcado por 4 ′, 6-diamidino-2-fenilindole (azul). (D) Imagem Bio-TEM da localização de nano girassóis de grande porte (topo, seta vermelha) no citoplasma e distribuição de pequenos NPs liberados (parte inferior, seta azul) no citoplasma e núcleo após irradiação NIR em células MCF-7. (E) Avaliação da citotoxicidade de células MCF-7 com tratamento de nano girassóis de 200 nm após irradiação NIR (após um período de tempo de pré-incubação:1, 3, 6, e 12 horas, respectivamente) em comparação com o controle, NPs Au-TIOP de 2 nm, Sequência POY2T, Sequência CA, NPs Au-POY2T de 2 nm, Nano girassóis de 200 nm sem irradiação NIR, e exposição NIR apenas. Todas as concentrações de tratamentos foram iguais ou iguais a 1 μM na sequência POY2T e foram testadas após um total de 24 horas de incubação. Valores médios ± SD, n =3. As diferenças estatísticas foram comparadas com o grupo de tratamento de ① NPs individuais de Au-POY2T de 2 nm determinados pelo teste t de Student bicaudal; * P <0,05 e ** P <0,01. (F) Nível de mRNA de C-myc determinado por PCR em tempo real após diferentes tratamentos, conforme descrito acima. Valores médios ± SD, n =3. As diferenças estatísticas foram determinadas pelo teste t de Student bicaudal; ** P <0,01 e *** P <0,001. (G) níveis de proteína C-myc determinados por Western blot e (H) histograma quantitativo correspondente após diferentes tratamentos, conforme descrito acima. GAPDH, gliceraldeído fosfato desidrogenase. Crédito:Science Advances, doi:10.1126 / sciadv.aaw6264
p Localização controlada de núcleos e estudo de silenciamento gênico in vitro de nanoestruturas automontadas. (A) Esquema da configuração experimental da célula in vitro para a localização controlada do núcleo NP e estudo da regulação do gene. (B) Número de NPs Au-POY2T de 2 nm localizados no núcleo da célula MCF-7 com tratamento de ① NPs Au-POY2T individuais de 2 nm, ② nano girassóis de 200 nm, e nano girassóis de 200 nm com irradiação NIR (10 min) após diferentes tempos de pré-incubação (③ 1, ④ 3, ⑤ 6, e ⑥ 12 horas). Valores médios ± SD, n =3. As diferenças estatísticas foram determinadas pelo teste t de Student bicaudal; * P <0,05 e ** P <0,01. (C) Observação confocal da distribuição de nano girassóis marcados com isotiocianato de fluoresceína (verde) antes (topo) e depois (parte inferior) da irradiação NIR em células MCF-7. O núcleo foi marcado por 4 ′, 6-diamidino-2-fenilindole (azul). (D) Imagem Bio-TEM da localização de nano girassóis de grande porte (topo, seta vermelha) no citoplasma e distribuição de pequenos NPs liberados (parte inferior, seta azul) no citoplasma e núcleo após irradiação NIR em células MCF-7. (E) Avaliação da citotoxicidade de células MCF-7 com tratamento de nano girassóis de 200 nm após irradiação NIR (após um período de tempo de pré-incubação:1, 3, 6, e 12 horas, respectivamente) em comparação com o controle, NPs Au-TIOP de 2 nm, Sequência POY2T, Sequência CA, NPs Au-POY2T de 2 nm, Nano girassóis de 200 nm sem irradiação NIR, e exposição NIR apenas. Todas as concentrações de tratamentos foram iguais ou iguais a 1 μM na sequência POY2T e foram testadas após um total de 24 horas de incubação. Valores médios ± SD, n =3. As diferenças estatísticas foram comparadas com o grupo de tratamento de ① NPs individuais de Au-POY2T de 2 nm determinados pelo teste t de Student bicaudal; * P <0,05 e ** P <0,01. (F) Nível de mRNA de C-myc determinado por PCR em tempo real após diferentes tratamentos, conforme descrito acima. Valores médios ± SD, n =3. As diferenças estatísticas foram determinadas pelo teste t de Student bicaudal; ** P <0,01 e *** P <0,001. (G) níveis de proteína C-myc determinados por Western blot e (H) histograma quantitativo correspondente após diferentes tratamentos, conforme descrito acima. GAPDH, gliceraldeído fosfato desidrogenase. Crédito:Science Advances, doi:10.1126 / sciadv.aaw6264
p Após a captação celular aprimorada de nanoestruturas automontadas in vitro, a equipe de pesquisa investigou a distribuição de nanopartículas dentro dos núcleos das células usando estratégias de "espera" e "ataque" após o disparo do NIR. Por esta, eles extraíram os núcleos das células após a incubação, para análise de ICP-MS após irradiação NIR em diversos períodos de incubação (um, três, seis e 12 horas). Eles observaram que o período de pré-incubação afeta amplamente a internalização de nanopartículas dentro do núcleo da célula, e os pesquisadores regularam NPs Au-POY2T no núcleo da célula com base no tempo de pré-incubação e irradiação NIR.
p Huo et al. também investigou os efeitos terapêuticos controlados por irradiação NIR de nano girassóis usando testes de viabilidade celular; eles observaram que o silenciamento do oncogene aumentou acentuadamente (80 por cento) e matou mais células cancerosas. A equipe de pesquisa controlou o impacto terapêutico de forma eficaz, alterando o cronograma de pré-incubação e irradiação de forma eficiente. Os resultados apoiaram uma habilidade superior dos nano girassóis transformáveis em silenciar o oncogene c-myc e a oncoproteína. Os cientistas controlaram o processo de silenciamento de genes ajustando os cronogramas de pré-incubação antes da irradiação NIR.
p
Controlando a inibição do crescimento do tumor usando nanossunflowers auto-organizados
p Para testar a eficiência anti-tumoral controlável de nano girassóis in vivo, os cientistas primeiro investigaram a compatibilidade do sangue para confirmar a boa biocompatibilidade do sangue. A equipe de pesquisa então estabeleceu o modelo de tumor MCF-7 usando os camundongos nus BALB / c, permitiu que os volumes do tumor atingissem 50 mm
3
e dividiu aleatoriamente os animais em nove grupos e os tratou com 1000 µl de várias formulações de POY2T. Após cada injeção, eles irradiaram os grupos de animais com lasers NIR por 10 minutos para atingir uma temperatura local acima de 41 graus C.
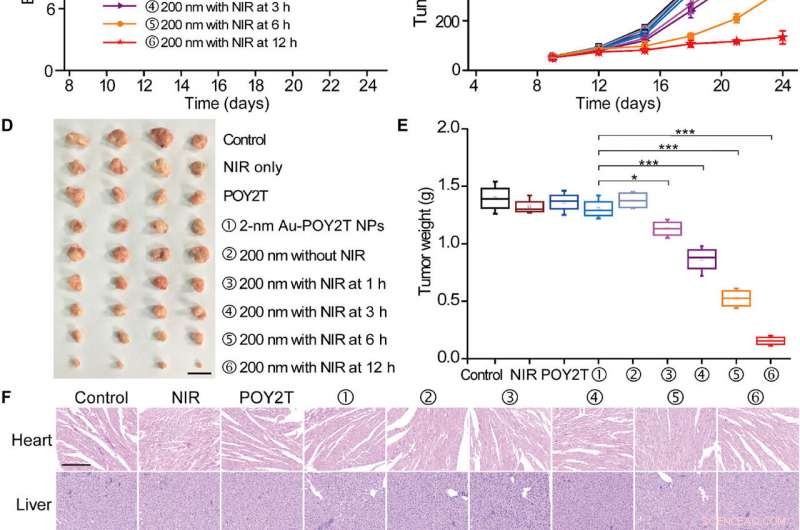 p Estudo da inibição do crescimento tumoral controlado das nanoestruturas automontadas. (A) O modelo de camundongos nus de tumor MCF-7 BALB / c foi estabelecido no dia 0. Após os tumores estarem prontos, os camundongos foram divididos aleatoriamente em nove grupos e tratados com 100 μl de várias formulações (equivalente a 10 μM na sequência POY2T; grupo ① com NPs Au-POY2T de 2 nm e grupos ②, ③, ④, ⑤, e ⑥ com nano girassóis de 200 nm) nos dias 9, 12, e 15. Nos grupos ③, ④, ⑤, e ⑥, os tumores foram irradiados com um laser NIR por 10 min a 1, 3, 6, e 12 horas após cada injeção intravenosa. Salina, NIR apenas, e POY2T foram usados como grupos de controle. Os (B) pesos corporais e (C) os volumes do tumor foram medidos a cada 3 dias. Barra de escala, 1 cm. Depois que os camundongos foram sacrificados no dia 24, todos os tumores foram (D) isolados e (E) pesados, respectivamente. Valores médios ± SD, n =4. As diferenças estatísticas foram determinadas pelo teste t de Student bicaudal; * P <0,05, ** P <0,01, e *** P <0,001. (Foto:Ningqiang Gong, Centro Nacional de Nanociência e Tecnologia, China.) (F) Imagens com coloração de hematoxilina e eosina de órgãos, incluindo o coração, fígado, baço, pulmão, rim, e tumor após diferentes tratamentos. Barra de escala, 200 μm. Crédito:Science Advances, doi:10.1126 / sciadv.aaw6264
p Estudo da inibição do crescimento tumoral controlado das nanoestruturas automontadas. (A) O modelo de camundongos nus de tumor MCF-7 BALB / c foi estabelecido no dia 0. Após os tumores estarem prontos, os camundongos foram divididos aleatoriamente em nove grupos e tratados com 100 μl de várias formulações (equivalente a 10 μM na sequência POY2T; grupo ① com NPs Au-POY2T de 2 nm e grupos ②, ③, ④, ⑤, e ⑥ com nano girassóis de 200 nm) nos dias 9, 12, e 15. Nos grupos ③, ④, ⑤, e ⑥, os tumores foram irradiados com um laser NIR por 10 min a 1, 3, 6, e 12 horas após cada injeção intravenosa. Salina, NIR apenas, e POY2T foram usados como grupos de controle. Os (B) pesos corporais e (C) os volumes do tumor foram medidos a cada 3 dias. Barra de escala, 1 cm. Depois que os camundongos foram sacrificados no dia 24, todos os tumores foram (D) isolados e (E) pesados, respectivamente. Valores médios ± SD, n =4. As diferenças estatísticas foram determinadas pelo teste t de Student bicaudal; * P <0,05, ** P <0,01, e *** P <0,001. (Foto:Ningqiang Gong, Centro Nacional de Nanociência e Tecnologia, China.) (F) Imagens com coloração de hematoxilina e eosina de órgãos, incluindo o coração, fígado, baço, pulmão, rim, e tumor após diferentes tratamentos. Barra de escala, 200 μm. Crédito:Science Advances, doi:10.1126 / sciadv.aaw6264
p De importância, camundongos tratados com o grupo tratado com nanosunflor e irradiados em 12 horas mostraram os efeitos antitumorais mais significativos, indicando a entrega eficiente de unidades de silenciamento de genes no local do tumor. Após 24 dias, Huo et al. sacrificou os animais, isolou os tumores e os pesou para demonstrar a inibição do crescimento do tumor controlada por NIR com base em nano-girassol in vivo. Com base em estudos histológicos, a equipe mostrou que o tratamento reduziu significativamente o crescimento do tumor e não afetou a morfologia de outros órgãos. Os resultados verificaram a eficiência terapêutica e a ausência de efeitos colaterais para nano girassóis e terapia NIR.
p Desta maneira, Shuaidong Huo e seus colegas projetaram, nanoagentes desenvolvidos e otimizados para terapia antitumoral eficaz. Eles projetaram nanoestruturas semelhantes a girassol auto-montadas para atuar como portadores de multipartículas carregados com muitas unidades terapêuticas ultrapequenas. Após a irradiação NIR, as nanoestruturas se dissociaram para liberar enxames de pequenos NPs para atingir o núcleo da célula. Em camundongos com tumor, os grandes girassóis direcionaram passivamente o local do tumor seguido por irradiação NIR para transformar a composição genética do tumor e reduzi-la. O objetivo da equipe de pesquisa é melhorar a eficiência da transfecção e fornecer um modelo para o silenciamento de genes controláveis em locais de tumor usando portadores de interferência de genes transformáveis para teranóstica intrincada no nível de uma única célula. p © 2019 Science X Network




