 p Cada subunidade de proteína tem uma cor diferente. O domínio V1 é o principal, Vo bottom, periféricos caem à esquerda e à direita. O fundo mostra uma bomba d'água movida a vento. Crédito:IST Áustria, 2019
p Cada subunidade de proteína tem uma cor diferente. O domínio V1 é o principal, Vo bottom, periféricos caem à esquerda e à direita. O fundo mostra uma bomba d'água movida a vento. Crédito:IST Áustria, 2019
p As células dependem de complexos de proteínas conhecidos como ATP sintases ou ATPases para suas necessidades de energia. As moléculas de trifosfato de adenosina (ATP) alimentam a maioria dos processos que sustentam a vida. O biólogo estrutural Professor Leonid Sazanov e seu grupo de pesquisa do Instituto de Ciência e Tecnologia da Áustria (IST Áustria) em Klosterneuburg, A Áustria já determinou a primeira estrutura atômica do representante da família V / A-ATPase, preenchendo a lacuna na árvore evolutiva dessas máquinas moleculares essenciais. Esses resultados obtidos usando os mais recentes métodos de microscopia crioeletrônica revelaram uma turbina ou moinho de água com estrutura semelhante da enzima e já foram publicados na revista.
Ciência . p
Poder rotativo
p ATP sintases / ATPases são grandes complexos de proteínas de membrana que compartilham planos gerais de construção bruta e mecanismos de catálise rotativa. Esta família de proteínas inclui a enzima do tipo F encontrada nas mitocôndrias (fábricas de energia da célula), cloroplastos (organelas que conduzem a fotossíntese nas plantas) e bactérias; Tipo V (vacuolar) encontrado em compartimentos intracelulares em eucariotos (organismos superiores com núcleo) e tipo A (arquea) encontrado em procariotos - arqueas (microrganismos antigos) e algumas bactérias.
p
Diferentes sabores de ATPases
p As enzimas do tipo F e A geralmente funcionam para produzir ATP, impulsionado pelo fluxo de prótons através da membrana. Enzimas do tipo V geralmente funcionam ao contrário, usando ATP para bombear prótons. V- e A-ATPases são estruturalmente semelhantes, mas diferem do tipo F por terem dois ou três caules periféricos e subunidades de proteína de conexão adicionais entre V1 e Vo. As enzimas do tipo V provavelmente evoluíram do tipo A e, devido a essas semelhanças, o tipo A também é denominado V / A-ATPase. Algumas bactérias, Incluindo
Thermus thermophilus , adquiriu uma enzima do tipo A. Long Zhou, pós-doutorado no grupo de pesquisa Sazanov do IST Áustria, purificou e estudou esta enzima (ThV1Vo) por crio-EM. Em contraste com o tipo F, para ATPases do tipo V, apenas as estruturas dos domínios V1 e Vo isolados foram determinadas previamente. Como V1 é acoplado a Vo, portanto, não era conhecido, e faltava o conhecimento sobre o ciclo catalítico completo.
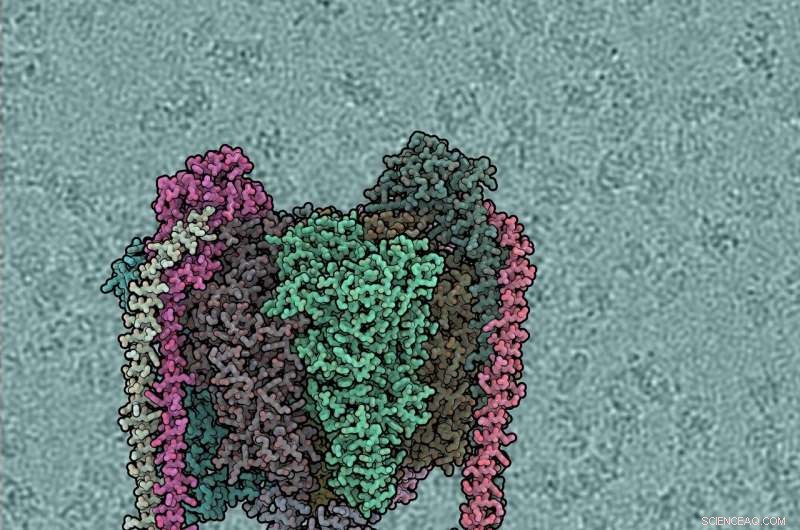 p Cada subunidade de proteína tem uma cor diferente. O domínio V1 é o principal, Vo bottom, periféricos caem à esquerda e à direita. O fundo mostra a micrografia crio-EM bruta, com moléculas individuais de ATPase visíveis. Crédito:IST Áustria, 2019
p Cada subunidade de proteína tem uma cor diferente. O domínio V1 é o principal, Vo bottom, periféricos caem à esquerda e à direita. O fundo mostra a micrografia crio-EM bruta, com moléculas individuais de ATPase visíveis. Crédito:IST Áustria, 2019
p
Plasticidade e competição
p Os cientistas não determinaram um, mas no total cinco estruturas de toda a enzima ThV1Vo, usando métodos de microscopia crioeletrônica desenvolvidos recentemente na chamada "revolução da resolução" desta técnica. As estruturas representam vários estados conformacionais da enzima diferindo pela posição do rotor dentro do estator. A plasticidade conformacional global de ThV1Vo é revelada como uma oscilação substancial de V1 no espaço na transição de um estado para outro. É o resultado da competição mecânica entre a rotação do rotor central dobrado e a rigidez do estator. O acoplamento V1-Vo é obtido por meio de uma combinação estrutural e eletrostática próxima entre o eixo e a subunidade específica do tipo V que o liga ao anel em C. A visualização do caminho do próton revelou diferenças significativas na distribuição de resíduos de proteína carregada daquela em F-ATPases, com um "ponto de verificação" mais estrito, evitando o "escorregamento" da enzima.
p
Por que complexidade adicional?
p Em vez de uma única haste periférica de enzimas do tipo F, Os tipos A, como ThV1Vo, têm duas hastes periféricas, enquanto os tipos V eucarióticos têm três. Mas qual é a vantagem da complexidade adicional na já muito grande montagem de proteína, junto com subunidades adicionais ligando V1 e Vo? O domínio F1 / V1 tem uma simetria tripla e, portanto, uma molécula de ATP é produzida (ou consumida) a cada 120 ° de rotação do estator dentro de F1 / V1. O professor Leonid Sazanov diz:"Em V / A-ATPases esta etapa é uma rotação única de 120 °, em contraste com a F-ATP sintase, onde é dividida em várias subetapas. Assim, maior plasticidade pode ser necessária no ThV1Vo a fim de ligar essas etapas de 120 ° em V1 a etapas menores por subunidade c no anel Vo c12. Esta flexibilidade adicional pode ser proporcionada nos tipos V por hastes periféricas adicionais e subunidades de conexão. Nossas novas estruturas mostram como isso é alcançado, fornecendo uma estrutura para toda a família V-ATPase ".

