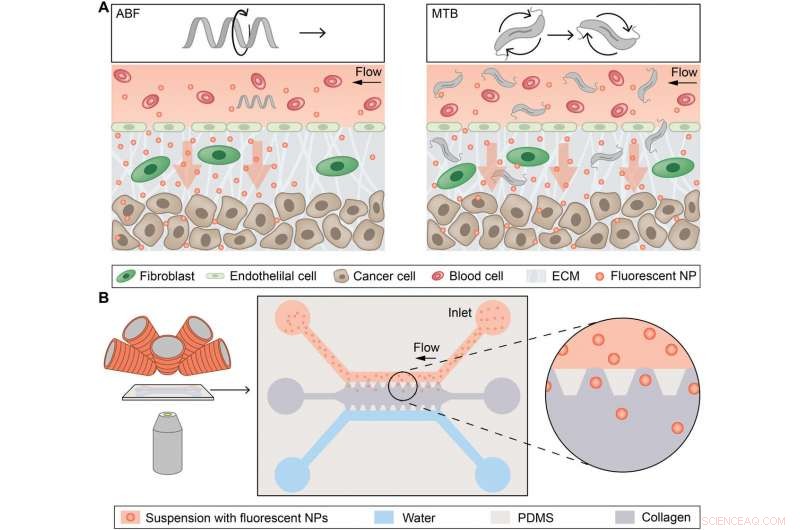
Visão geral conceitual de micropropulsores controlados magneticamente para transporte NP aprimorado por convecção. (A) Esquema conceitual representando um único microrrobô, o flagelo bacteriano artificial (ABF), aumentando o transporte de massa de nanopartículas (NPs) na interface vaso-tecido (esquerda), e enxames de bactérias magnetotáticas (MTB) gerando fluxo convectivo para melhorar o transporte de massa (direita). ECM, Matriz extracelular. (B) Esquema da plataforma magnetofluídica para estudos de transporte de massa NP usando convecção induzida magneticamente. O chip microfluídico é colocado entre a lente objetiva de um microscópio óptico invertido e os eletroímãs (à esquerda). Um esquema representa o chip, consistindo em um canal superior preenchido com NPs (vermelho) e um canal inferior de água (azul) que ambos fazem fronteira com uma matriz de colágeno (cinza) ao longo de postes trapezoidais de restrição feitos de PDMS. NPs podem se difundir passivamente na matriz de colágeno ao longo de seu gradiente de concentração em direção ao canal de água. Crédito: Avanços da Ciência , doi:10.1126 / sciadv.aav4803
Nanopartículas (NPs) são uma plataforma promissora para a entrega de drogas para tratar uma variedade de doenças, incluindo câncer, doença cardiovascular e inflamação. No entanto, a eficiência da transferência de NP para o tecido doente de interesse é limitada devido a uma variedade de barreiras fisiológicas. Um obstáculo significativo é o transporte de NPs para atingir com precisão o tecido-alvo de interesse. Em um estudo recente, S. Schuerle e uma equipe de pesquisadores interdisciplinares dos departamentos de Medicina Translacional, Biofísica, Robótica de Engenharia, Nanomedicina e Eletrônica, na Suíça, o Reino Unido e os EUA desenvolveram dois micropropulsores baseados em microrrobôs distintos para enfrentar o desafio.
Eles usaram campos magnéticos rotativos (RMFs) para alimentar os dispositivos e criar convecção de fluido local para superar o transporte limitado de difusão de nanopartículas. Durante a primeira abordagem experimental, eles usaram um único microrrobô magnético sintético como um flagelo bacteriano artificial (ABF) e, em seguida, usaram enxames de uma bactéria magnetotática natural (MTB) para criar um "ferrofluido vivo", explorando a ferrohidrodinâmica. Usando ambas as abordagens, os cientistas aumentaram o transporte de NPs em um modelo microfluídico de extravasamento de sangue (movimento de uma droga dos vasos sanguíneos para o tecido externo) e penetração no tecido em microcanais cercados por uma matriz de colágeno para criar uma interface biomimética tecido-vaso no laboratório. Os resultados do estudo estão agora publicados em Avanços da Ciência .
Nanopartículas (NPs) são cada vez mais populares na nanomedicina devido ao potencial da pesquisa biomédica como transportadores na entrega de medicamentos que ultrapassam os limites da medicina convencional. Embora os NPs sejam projetados para alterar a farmacocinética e a biodistribuição dos medicamentos existentes, eles são impedidos por barreiras fisiológicas, que evitam o acúmulo de sucesso nos locais da doença, limitando seus efeitos terapêuticos in vivo. Durante a terapia do câncer, por exemplo, os portadores de drogas encontram vasos anormais que circundam a arquitetura do tumor para a liberação ineficaz da droga intravenosa.
Uma vez que a distribuição de NPs nos tecidos é fortemente influenciada por suas propriedades físico-químicas, os cientistas redesenharam as formas e tamanhos do NP para otimizar sua cinética de transporte através das paredes dos vasos para alcançar os tecidos. Os pesquisadores já haviam proposto abordagens em vários estágios para a entrega otimizada de medicamentos, seja reduzindo as nanopartículas no tempo, ou fragmentá-los para dispersar e alcançar um local de interesse somente após encontrar sinais microambientais de doença in vivo.

O flagelo bacteriano artificial (ABF) em um dispositivo de fluxo único de fluido semelhante a microvasos. Crédito:Science Advances, doi:10.1126 / sciadv.aav4803
Geralmente, O transporte NP é afetado pela carga superficial, hidrofobicidade e bioquímica de superfície; propriedades que podem ser ativamente otimizadas em trabalhos de pesquisa para um tráfico in vivo mais eficaz. Os cientistas usaram fontes externas de energia, como forças magnéticas e acústicas, para criar micro-robôs controlados sem fio e transportar as terapias para o tecido doente para melhorar o transporte difusivo. Contudo, esses métodos ainda dependiam de transporte difusivo após a liberação de sua carga a bordo, enquanto permanece a necessidade de estratégias mais distintas de transporte para um local definido.
No presente trabalho, Schuerle et al. detalhou duas estratégias distintas para gerar fluxo convectivo localizado sem fio para evitar a invasão de nanopartículas implantadas. Inspirado no campo dos microrrobôs (microbots), os cientistas usaram (1) um único, sintético, microrrobô inspirado em bactérias, ou (2) grandes enxames de bactérias vivas para conduzir o transporte de NP localizado. Os micropropulsores artificiais e naturais auxiliaram o processo, promovendo a convecção conduzida magneticamente em um local definido em uma configuração magnetofluídica com potencial para aplicações terapêuticas.
O microbot sintético imitou a propulsão bacteriana usando um flagelo bacteriano artificial (ABF), enquanto os densos enxames de bactérias magnetotáticas (MTB) aproveitados por Schuerle et al. ocorreu naturalmente como procariotos gram-negativos ( Magnetospirillum magnetum ) com propriedades magnéticas. Os cientistas esperam que os resultados superem as barreiras de transporte existentes para uma maior penetração no tecido NP via controle sem fio e convecção local espacialmente precisa no futuro.
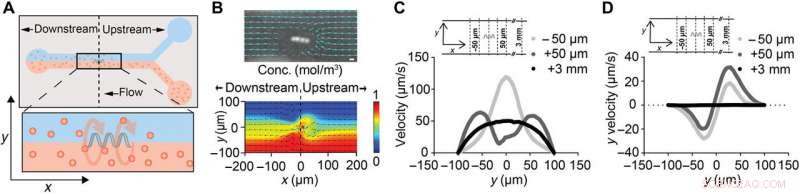
ABF perturba localmente o fluxo de fluido. (A) Esquema de um canal microfluídico de 200 μm de largura com ABF suspenso (36 μm de comprimento, 10 μm de diâmetro) posicionado no centro do canal (x, y, z) =(0, 0, 0). O canal superior contém água, enquanto o canal inferior contém NPs fluorescentes de 200 nm. (B) Instantâneo de ABF em um canal de 200 μm de largura perturbando os caminhos rastreados dos NPs fluorescentes de 200 nm indicando fluxo de fluido. Barra de escala (topo), 10 μm. Uma simulação numérica de fluxo de dois fluidos com um ABF na interface, com cor indicando distribuição de concentração (vermelho, 1 mol / m3; azul, 0 mol / m3) de espécies moleculares (parte inferior). (C) Perfil de velocidade nas posições a montante e a jusante do ABF. Para o controle, em x =+3 mm, um perfil laminar não perturbado com velocidade de pico de 50 μm / s foi simulado. Em ambos x =+50 μm (a montante) e x =−50 μm (a jusante), um aumento nas velocidades de pico é previsto, com o pico deslocado para mais perto da parede do canal para o caso a montante. (D) Resultados da simulação para o componente de velocidade y uy (ortogonal para e fora do canal) nas mesmas posições que (C). Nas proximidades da ABF, um impulso ortogonal direcionado à direção do fluxo em direção à parede do canal é previsto. Crédito:Science Advances, doi:10.1126 / sciadv.aav4803
Schuerle et al. projetou o ABF magnético usando litografia tridimensional (3-D) e deposição de metal, conforme relatado anteriormente. Os microrrobôs com bioinspiração imitaram os flagelos rotativos para uma locomoção eficiente baseada na propulsão em microescala - onde as forças de arrasto viscosas dominam. Eles controlaram o movimento ABF com campos magnéticos uniformes em rotação 3-D usando uma configuração de controle magnético sem fio contendo eletroímãs dispostos em torno de um único hemisfério.
Em seguida, eles montaram a configuração em um microscópio invertido para rastrear os movimentos dos microrrobôs controlados. Os campos magnéticos rotativos (RMFs) permitiram a propulsão direta e o fluxo convectivo no fluido circundante e quando os cientistas imergiram o ABF em uma suspensão de NPs fluorescentes, eles observaram fluxo controlado para o transporte de massa dos NPs.
No experimento, eles construíram a camada inferior do canal microfluídico para conter os NPs de 200 nm semelhantes ao tamanho usado em aplicações clínicas, enquanto na camada de fluido superior eles mantiveram uma suspensão de meio aquoso puro. Os cientistas posicionaram o ABF no centro da configuração para sustentar sua posição contra o fluxo, controlando o fluxo do fluido na configuração. Este arranjo do ABF em um canal microfluídico interrompeu o fluxo laminar para produzir convecção, que transportou NPs da camada de fluido na parte inferior para a camada superior - para alcançar a parede do canal, ou seja, o local de interesse.
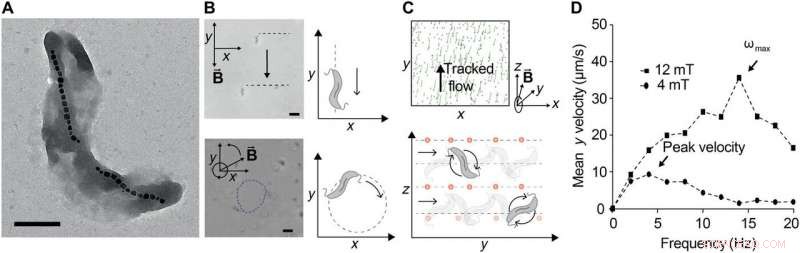
Bombeamento ferro-hidrodinâmico com enxames controlados de MTB. (A) Micrografia eletrônica de transmissão de M. magnética cepa AMB-1. Barra de escala, 0,5 μm. Os magnetossomos são claramente visíveis, aqui formado em duas cordas distintas de cristais de óxido de ferro. (B) Controle de AMB-1 sob campos magnéticos estáticos (topo) e campos magnéticos girando no plano a 1 Hz. Barra de escala (inferior), 5 μm. (C) Imagens pós-processadas de rastreados, co-suspenso, não magnético, NPs fluorescentes usados para observar os campos de fluxo gerados por um enxame de MTB exposto a um campo magnético de 12 mT girando a 10 Hz no plano y-z. Os traços em verde correspondem às trajetórias percorridas em 12 quadros (~ 1 s). As posições são calculadas usando filtro passa-banda com 25 pixels de diâmetro, seguido pela descoberta do pico (topo). O movimento bacteriano pode ser dirigido mudando a direção do vetor do campo magnético rotativo, porque o MTB se translada dentro do plano de rotação (parte inferior). Para um vetor RMF em torno do eixo x, bactérias giram ao longo de y, gerando um fluxo que transporta NPs ao longo de y. (D) A velocidade de translação é plotada versus a frequência de rotação aplicada em duas intensidades de campo magnético diferentes. A velocidade translacional aumenta com a frequência inicialmente, mas em frequências suficientemente altas, diminui porque o torque de arrasto fluídico supera o torque magnético para impedi-los de acompanhar a rotação do campo. A frequência máxima sincronizada, também correspondendo à velocidade máxima de translação, é referido como frequência de saída ωmax. Quando a intensidade do campo magnético é aumentada, a frequência de saída aumenta, conforme observado. Crédito:Science Advances, doi:10.1126 / sciadv.aav4803
Os cientistas também desenvolveram um modelo de fluxo de fluido único em um microcanal para formar um microvaso bioinspirado com escalas biomiméticas e taxas de fluxo de fluido. O modelo continha colágeno concentrado no centro que imitava a matriz extracelular nativa. Usando o dispositivo, Schuerle et al. quantificou a intensidade fluorescente na matriz biomimética para testar se o ABF controlado magneticamente poderia aumentar o transporte de massa de NPs marcados com fluorescência para a matriz que mimetiza o tecido. Os resultados indicaram que ABFs foram limitados como um micropropller convectivo em vasos menores, mas isso pode ser alterado dimensionando a estrutura ABF para se adequar ao tamanho do canal no futuro.
Os cientistas consideraram os efeitos de todo um enxame de hélices menores de microrrobôs a seguir. Por esta, Schuerle et al. selecionou a cepa de MTB de tipo selvagem AMB-1 ( Magnetospirillum magnetum ) para formar magnetossomos. Os microrganismos produziram naturalmente cadeias de partículas de óxido de ferro em bicamadas lipídicas da membrana plasmática para movimento manipulado usando campos magnéticos externos. Embora os pesquisadores tenham usado MTBs em estudos anteriores como veículos potenciais de entrega de drogas com campos magnéticos externos, Schuerle et al. utilizou campos magnéticos rotacionais (RMFs) no presente trabalho. Os RMFs forçaram o movimento de um enxame de MTB para conduzir seu movimento por meio de torque magnético.
Controle de MTB marcado com fluorescência verde em dispositivo microfluídico, quando o RMF está ligado / desligado. Crédito:Science Advances, doi:10.1126 / sciadv.aav4803
Os cientistas reduziram a distância média entre as bactérias usando uma alta concentração de MTBs para pressionar as células vizinhas para frente em enxames 3-D dominados por forças hidrodinâmicas. Eles não observaram aglomeração ou agregação dos magnetossomos de MTB quando expostos a RMFs, uma vez que os magnetossomos eram inerentemente protegidos pelas membranas das células bacterianas para um fluxo de fluido controlado. Schuerle et al. repetiu os experimentos de biomimética usando um dispositivo microfluídico contendo colágeno para mostrar que enxames de MTB podiam penetrar no colágeno, quando concentrações suficientemente altas de MTBs foram usadas.
Desta maneira, usando duas estratégias experimentais Schuerle et al. melhorou o transporte de massa de NPs, via fluxo convectivo gerado por micropropulsores controlados magneticamente. Os experimentos microrobóticos mostraram que ABF mimetizou um flagelo bacteriano para auxiliar o acúmulo de NP e a penetração em uma matriz de colágeno densa - quando atuado por RMFs. Schuerle et al. propor a inclusão de tais ABFs estacionários em stents para desencadear a liberação do medicamento e melhorar a penetração em um local de interesse para neutralizar a inflamação sob demanda.
Com a segunda estratégia, eles se concentraram em gerar a mesma técnica, mas com cepas bacterianas magnetotáticas (MTBs). Com base no presente trabalho e nas propriedades de homing de tumor existentes de MTBs, os cientistas imaginam enxames controlados magneticamente de MTBs 3-D para transportar NPs no espaço do fluido intersticial de microambientes tumorais. Os cientistas irão otimizar a densidade das bactérias para uma dose compatível in vivo e o trabalho abrirá o caminho para novos estudos em micro e nanomateriais para o transporte magneticamente aprimorado de NP em nanomedicina clínica.
© 2019 Science X Network