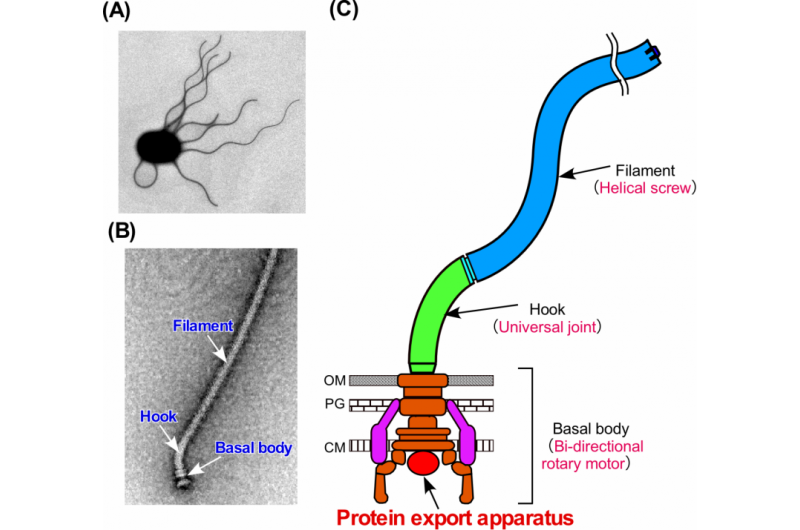
 p Figura 1. O flagelo bacteriano. (A) Micrografia eletrônica de uma célula de Salmonella. (B) Micrografia eletrônica do flagelo de Salmonella. (C) Diagrama esquemático do flagelo. O flagelo consiste em pelo menos três partes:o corpo basal como um motor rotativo bidirecional, o gancho como junta universal e o filamento como parafuso helicoidal. Crédito:Universidade de Osaka
p Figura 1. O flagelo bacteriano. (A) Micrografia eletrônica de uma célula de Salmonella. (B) Micrografia eletrônica do flagelo de Salmonella. (C) Diagrama esquemático do flagelo. O flagelo consiste em pelo menos três partes:o corpo basal como um motor rotativo bidirecional, o gancho como junta universal e o filamento como parafuso helicoidal. Crédito:Universidade de Osaka
p Os pesquisadores da Universidade de Osaka usam cristalografia de raios-X e microscopia eletrônica para resolver a montagem do aparelho de porta de exportação em Salmonella. Espera-se que os novos detalhes desta nanomáquina esclareçam como as bactérias infectam as células eucarióticas e apresentem novos alvos moleculares para a descoberta de medicamentos. p Uma das nanomáquinas mais antigas da biologia é o flagelo bacteriano. Este aparato é essencial para a evolução, dando às bactérias a capacidade de se mover. O flagelo compartilha grande semelhança com outra estrutura bacteriana, o injetável, que, como o nome indica, é como algumas bactérias entregam seu conteúdo para infectar um hospedeiro. Um novo estudo realizado por pesquisadores da Universidade de Osaka revela como uma estrutura específica no flagelo e no injetável, o complexo do portão de exportação, monta dinamicamente e como impedir essa montagem pode tornar as bactérias inócuas. O estudo pode ser visto em
PLOS Biology .
p O professor associado Tohru Minamino da Escola de Graduação em Biociências de Fronteira tem estudado o complexo do portão de exportação por muitos anos usando microscopia eletrônica. Seu interesse neste complexo é principalmente na engenharia de novas nanomáquinas, mas ele percebeu que a mesma pesquisa pode ter implicações médicas.
p "Existem muitas semelhanças estruturais e funcionais entre as proteínas flagelares e injetáveis. Elas podem ser bons alvos para inibir a infecção bacteriana, " ele disse.
 p Figura 2. Modelo da estrutura do anel FliP. FliP forma um homo-hexâmero. O complexo FliO atua como um andaime para se ligar ao FliP para facilitar a formação do anel FliP. Crédito:Universidade de Osaka
p Figura 2. Modelo da estrutura do anel FliP. FliP forma um homo-hexâmero. O complexo FliO atua como um andaime para se ligar ao FliP para facilitar a formação do anel FliP. Crédito:Universidade de Osaka
p O complexo de exportação em Salmonella flagelo consiste em cinco proteínas transmembrana. Estes serão montados sequencialmente para formar a porta de exportação, começando com a proteína FliP. Acredita-se que a porta de exportação em Salmonella injetisome se reúna de forma semelhante usando cinco proteínas homólogas. Minamino mostra que embora não faça parte da estrutura do portão, uma sexta proteína transmembrana, FliO, é essencial para iniciar a montagem do portão.
p "O FliO atua como um andaime para o FliP formar uma estrutura em anel. Sem esse anel, as outras proteínas transmembrana não seguirão para o complexo de portão, " ele disse.
p Imagens de microscopia eletrônica indicaram que o andaime FliO faz com que FliP forme um hexâmero, o que permite que proteínas transmembranares subsequentes se juntem à montagem. Cálculos eletrostáticos identificaram quais aminoácidos específicos no FliP eram críticos para as interações FliO-FliP e FliP-FliP, fornecendo alvos candidatos para drogas experimentais. Para demonstrar que o FliO é necessário para a montagem do portão de exportação e não a estrutura, Minamino mostrou que a superexpressão de FliP pode contornar o defeito FliO e prosseguir para completar o aparato de porta de exportação.
p Embora o FliO permita que o FliP forme um hexâmero, a proteína homóloga FliP no injetisome, SpaP, forma um pentemer e um hetero-hexâmero junto com SpaR, a proteína homóloga FliR. A análise computacional sugeriu que o FliP também poderia ter essa estrutura.
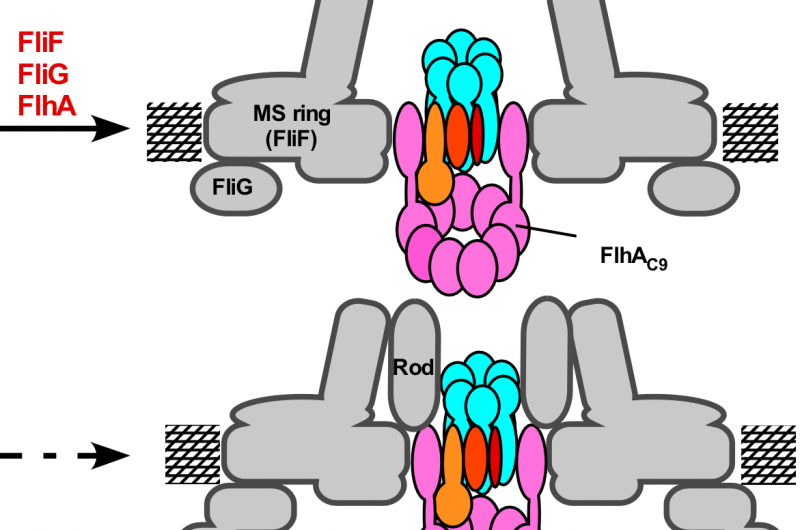 p Figura 3. Modelo do processo de montagem do aparato de exportação flagelar. A montagem do complexo de portões de exportação começa com a formação do anel FliP com a ajuda do complexo FliO, seguida pela montagem do FliQ, FliR, e FlhB e finalmente de FlhA durante a formação do anel de MS na membrana citoplasmática. Após a conclusão da estrutura do anel C, o complexo do anel citoplasmático ATPase é formado na base flagelar, permitindo que os substratos de exportação entrem na cavidade central do complexo do anel FliP. Crédito:Universidade de Osaka
p Figura 3. Modelo do processo de montagem do aparato de exportação flagelar. A montagem do complexo de portões de exportação começa com a formação do anel FliP com a ajuda do complexo FliO, seguida pela montagem do FliQ, FliR, e FlhB e finalmente de FlhA durante a formação do anel de MS na membrana citoplasmática. Após a conclusão da estrutura do anel C, o complexo do anel citoplasmático ATPase é formado na base flagelar, permitindo que os substratos de exportação entrem na cavidade central do complexo do anel FliP. Crédito:Universidade de Osaka
p "Um número significativo de partículas de anel FliP que analisamos pode ser atribuído a uma análise rotacional de 5 vezes, para que eles pudessem formar pentâmeros. Estamos confiantes de que FliP é um bom modelo para SpaP, "disse Minamino.
p Identificação da primeira etapa para montagem do portão de exportação, a saber, a oligmerização de FliP por meio de interações FliO, sugere uma forma potencial de interromper a patologia de bactérias como a Salmonella.
p "Nossas descobertas sugerem que os homólogos FliP do injetisome são alvos de drogas promissores, "disse Minamino.


