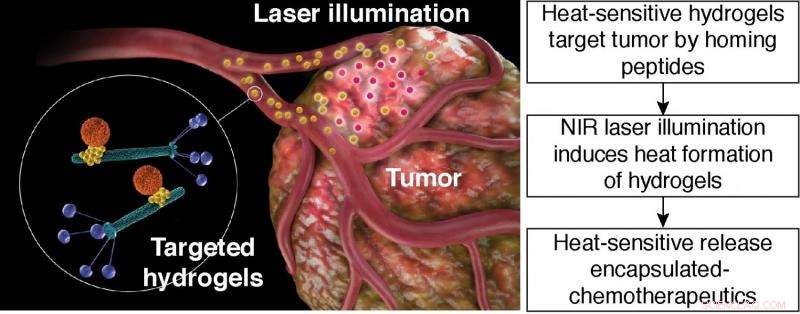
 p Liberação sensível ao calor de quimioterápicos encapsulados. Ilustração esquemática da terapia fototérmica com hidrogel direcionado. Hidrogel direcionado:partícula laranja, nanocarreador baseado em lipossoma; partícula amarela, Nanopartícula de ouro; varas verdes, partículas de bacteriófago com ligantes peptídicos exibidos na proteína de revestimento do fago (azul). Crédito:Hosoya, et al.
p Liberação sensível ao calor de quimioterápicos encapsulados. Ilustração esquemática da terapia fototérmica com hidrogel direcionado. Hidrogel direcionado:partícula laranja, nanocarreador baseado em lipossoma; partícula amarela, Nanopartícula de ouro; varas verdes, partículas de bacteriófago com ligantes peptídicos exibidos na proteína de revestimento do fago (azul). Crédito:Hosoya, et al.
p (Phys.org) - Nanopartículas funcionalizadas são uma via de distribuição de drogas para quimioterápicos. Contudo, obter nanopartículas para atingir o local do tumor tem se mostrado difícil de fazer. Um método que os pesquisadores usaram para atingir as células cancerosas é criar hidrogéis feitos de bacteriófago filamentoso (fago) e nanopartículas de ouro. Os ligandos de ligação de péptidos podem ser incorporados na porção fágica do hidrogel que irá então ter como alvo células de carcinoma conhecidas. p Um grupo interdisciplinar de pesquisadores de várias universidades no Japão, os EUA., e a Alemanha desenvolveram uma plataforma de hidrogel que pode atingir tumores, fornecer imagens não invasivas, e liberar um medicamento quimioterápico. Eles demonstraram sua plataforma em estudos in vitro e em modelos de camundongos. Adicionalmente, eles demonstram que sua plataforma é generalizável para diferentes alvos e quimioterápicos. Seu trabalho aparece no
Proceedings of the National Academy of Sciences .
p Hosoya, a plataforma de hidrogel de et al. consiste em bacteriófago, nanopartículas de ouro, e veículos de tamanho nano, tais como lipossomas ou partículas de sílica mesopourosa. Neste cenário, As partículas de fago são capazes de reconhecer moléculas específicas nas células tumorais. As nanopartículas de ouro servem como um "repórter" para a distribuição do hidrogel. O nanocarreador transporta vários produtos químicos ou cargas farmacêuticas. O nanocarreador libera carga sob um estímulo específico, como calor.
p No trabalho atual, Hosoya, et al. provou pela primeira vez que os lipossomas sensíveis ao calor (HSLs) serviriam como um portador sensível ao calor formidável. Em teoria, quando o HSL começa a derreter, ele libera a droga que está incorporada a ele. Usando calceína, uma molécula fluorescente ativa, eles determinaram que HSL liberou calceína ao atingir 40
o
C, como previsto. Quando o HSL foi deixado em uma temperatura constante (42
o
C), ele liberou toda a calceína em 10 minutos. Hosoya, et al. em seguida, provou que esses HSLs ainda respondiam às mudanças de temperatura quando incorporados à plataforma de hidrogel.
p A próxima etapa foi demonstrar que os hidrogéis contendo HSL responderam ao aquecimento NIR enquanto dentro de uma matriz. Os autores usaram gel de agarose como sistema modelo. Eles descobriram que o hidrogel contendo HSL respondeu ao aquecimento NIR e conforme a potência do laser aumentou, a temperatura do hidrogel aumentou. Eles então determinaram se o aquecimento do NIR desencadearia a liberação de doxorrubicina (dox), um quimioterápico. Eles foram capazes de produzir um "aumento dependente da dose de fótons reprodutível e robusto na intensidade de fluorescência."
p Para determinar a distribuição de calor no hidrogel do NIR, eles usaram imagens de temperatura de ressonância magnética nos hidrogéis contendo HSL na plataforma de agarose. As imagens do gradiente térmico confirmaram que o calor centralizado foi produzido pelo hidrogel via laser NIR. Eles usaram hidrogéis contendo HSL encapsulados em gadolínio para confirmar que a liberação da droga ocorreu no local do feixe de laser.
p Embora esses resultados mostrem que a liberação do medicamento pode ser controlada usando NIR, eles ainda precisam testar se o sistema pode ter como alvo o local do câncer. Para fazer isso, Hosoya, et al incorporaram um ligante que possui um peptídeo cíclico bem estabelecido que se liga a CRKL. As partículas de fago de ligação a CRKL têm como alvo EF43.
fgf-4 células de carcinoma mamário. Usando hidrogéis contendo HSL marcados com rodamina, eles demonstraram que o fago tinha como alvo as células do carcinoma, confirmando que ainda mantém suas propriedades de ligação, mesmo quando incorporado na nanoplataforma.
p Eles então fizeram testes in vivo em camundongos. Eles rastrearam a localização e os efeitos de sua plataforma de hidrogel contendo HSL em camundongos que tinham EF43.
fgf-4 carcinoma mamário. Estudos de imagem de fluorescência óptica mostraram que o tumor era visível em camundongos tratados com o sistema de hidrogel direcionado em comparação com os controles. A análise dos tumores após 24 h revelou que as nanopartículas de ouro, fago direcionado, e HSLs foram localizados dentro do tumor. Estudos adicionais para ver se seu sistema poderia então liberar um quimioterápico usando NIR no local do tumor também foram bem-sucedidos. Os autores observaram redução do crescimento do tumor em camundongos com hidrogéis contendo HSL com dox, e confirmou seus resultados usando modelagem matemática.
p Finalmente, para testar a versatilidade de sua nanoplataforma de hidrogel, Hosoya, et al. nanopartículas de sílica mesoporosa (MSNP) incorporadas ao sistema de hidrogel. As propriedades químicas do MSNP permitem embalar diferentes quimioterápicos. Eles testaram se os hidrogéis contendo MSNP poderiam fornecer FITC em dois modelos de câncer diferentes, o mesmo modelo de câncer de mama usado anteriormente (EF43.
fgf-4 ) e um modelo para câncer de próstata. Eles descobriram uma ligação direcionada aos dois cânceres e estudos com dox mostraram uma diminuição no tamanho do tumor.
p Este trabalho demonstra uma plataforma de hidrogel que não altera as propriedades físicas ou químicas de sistemas nanocarreadores conhecidos, como lipossomas sensíveis ao calor ou nanopartículas de sílica mesoporosa. Esta plataforma permite a segmentação, entrega induzida por calor, e é versátil e reproduzível. Com estudos adicionais, este sistema pode ser geral, método robusto para entrega de drogas direcionadas. p © 2016 Phys.org
