 p Os cientistas conseguiram registrar o potencial elétrico através da membrana das células cardíacas em contração (símbolo). Crédito:Keystone / Science Photo Library / Beermedia / Fotolia / Montage
p Os cientistas conseguiram registrar o potencial elétrico através da membrana das células cardíacas em contração (símbolo). Crédito:Keystone / Science Photo Library / Beermedia / Fotolia / Montage
p Pela primeira vez, os cientistas conseguiram registrar a corrente nos canais de membrana das células cardíacas em contração. Para fazer isso, os cientistas combinaram um microscópio de força atômica com um método amplamente usado para medir sinais elétricos em células. p Os impulsos elétricos desempenham um papel importante nas células do corpo humano. Por exemplo, os neurônios usam esses impulsos para transmitir informações ao longo de seus ramos e o corpo também os usa para controlar a contração dos músculos. Os impulsos são gerados quando proteínas de canais especiais se abrem no envelope externo das células, permitindo que moléculas carregadas (íons) entrem ou saiam da célula. Essas proteínas são chamadas de canais iônicos. Desde a década de 1970, um método está disponível para pesquisadores que permite a medição da atividade desses canais, mas até agora este método foi usado principalmente em células que não se movem. Engenheiros elétricos da ETH Zurique e biólogos da Universidade de Berna desenvolveram ainda mais o método, para que possam registrar facilmente a atividade das células em movimento, como bater as células do músculo cardíaco em um prato de cultura de tecidos.
p O método existente envolve o posicionamento de uma pipeta de vidro contra a membrana externa de uma célula. A abertura na ponta da pipeta é tão pequena que toca apenas uma fração da superfície da célula. Idealmente, esse minúsculo pedaço de membrana celular tem exatamente um canal iônico. O interior da pipeta é preenchido com um fluido condutor e um eletrodo, o que torna possível medir as diferenças de carga entre a parte externa da célula e o interior da célula (ou seja, um potencial elétrico) e as alterações temporárias neste potencial resultantes da atividade nos canais iônicos. O método é conhecido como técnica de patch-clamp porque a pipeta é usada para prender um patch da membrana celular.
p
Microscópio de força atômica com agulha de microinjeção
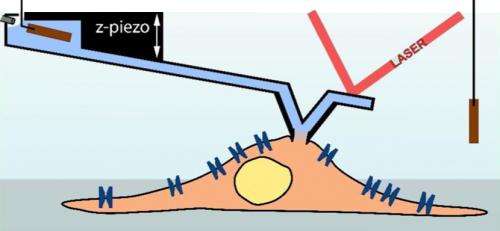 p Uma agulha de registro de microscópio de força atômica (azul claro) serve como uma pipeta para medir uma célula (marrom claro; esquema). (Ilustração:Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society) Uma agulha de registro de microscópio de força atômica (azul claro) serve como uma pipeta para medir uma célula (marrom claro; esquema). Crédito:Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society
p Uma agulha de registro de microscópio de força atômica (azul claro) serve como uma pipeta para medir uma célula (marrom claro; esquema). (Ilustração:Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society) Uma agulha de registro de microscópio de força atômica (azul claro) serve como uma pipeta para medir uma célula (marrom claro; esquema). Crédito:Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society
p Liderado por Tomaso Zambelli, professor do Instituto de Engenharia Biomédica da ETH Zurique, e Hugues Abriel, professor do Departamento de Pesquisa Clínica da Universidade de Berna, os pesquisadores agora combinaram esta técnica com um microscópio de força atômica. Uma ponta do sensor é assentada em uma montagem móvel - o chamado cantilever - para escanear a superfície do objeto microscópico. Vários anos atrás, os pesquisadores conseguiram produzir pontas de sensores com um canal interno, que permite a injeção controlada por computador de moléculas em uma célula. Essa técnica agora está sendo comercializada pela Cytosurge, spin-off da ETH. Contudo, os cientistas continuaram o desenvolvimento desta técnica ajustando a agulha de microinjeção com um eletrodo para realizar medições de patch-clamp. Os pesquisadores já publicaram os resultados de sucesso deste empreendimento na revista.
Nano Letras .
p A técnica de patch-clamp não é apenas um método central para a pesquisa básica em biologia celular, também é usado rotineiramente no desenvolvimento de novos medicamentos. Por exemplo, a indústria farmacêutica é legalmente exigida como parte do processo de aprovação de novos medicamentos para testar se esses medicamentos interagem com os canais iônicos. Um medicamento que bloqueia os canais iônicos pode causar disritmia cardíaca grave em pacientes, que deve ser evitado a todo custo.
p
Medições e automação mais longas possíveis
p No caso da técnica de patch-clamp convencional, um operador posiciona manualmente a pipeta contra a célula; embora existam procedimentos automatizados, suas aplicações são limitadas. Assim, as células em teste devem ter o mesmo tamanho e formato e não devem se mover (como as células cardíacas fazem).
p No caso do novo método, a micro-agulha é controlada por um computador usando medições de força do microscópio de força atômica para mantê-la a uma curta distância constante da superfície da célula. "Isso torna o contato entre a agulha e a célula muito mais estável, o que nos permite fazer medições por um longo período de tempo e até mesmo testar células em movimento, "explica Zambelli. Pela primeira vez, os pesquisadores conseguiram, assim, medir as mudanças do potencial elétrico nos canais iônicos das células cardíacas em movimento. Zambelli diz que também pode imaginar usar isso como base para o desenvolvimento de um método automatizado para testar qualquer célula, independentemente de sua forma ou tamanho.

