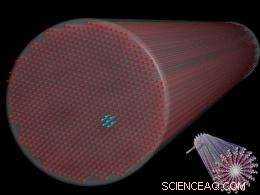
 p Fig 1. Um desenho que representa um feixe de filamentos de peptídeos de 10 nanômetros de diâmetro posicionados em uma matriz hexagonal. Fenômenos semelhantes podem ocorrer naturalmente nos citoesqueletos das células, a córnea do olho, e outras áreas da biologia. A inserção (no canto inferior direito) mostra a estrutura molecular de filamentos individuais. (Imagem cortesia de S.I. Stupp.)
p Fig 1. Um desenho que representa um feixe de filamentos de peptídeos de 10 nanômetros de diâmetro posicionados em uma matriz hexagonal. Fenômenos semelhantes podem ocorrer naturalmente nos citoesqueletos das células, a córnea do olho, e outras áreas da biologia. A inserção (no canto inferior direito) mostra a estrutura molecular de filamentos individuais. (Imagem cortesia de S.I. Stupp.)
p (PhysOrg.com) - As experiências às vezes podem levar à descoberta de fenômenos completamente imprevistos. Esse é o caso do notável comportamento exibido por nanoestruturas de peptídeos (na forma de filamentos supramoleculares) observados durante experimentos realizados por pesquisadores da Northwestern University na linha de luz 5-ID da DuPont-Northwestern-Dow Collaborative Access Team (DND-CAT) Centro de Pesquisa de Síncrotron da Fonte Avançada de Fótons (APS) do Departamento de Energia dos EUA no Laboratório Nacional de Argonne. p De acordo com o professor Samuel Stupp, autor principal do estudo publicado recentemente em
Ciência , ao "tentar elucidar a organização hierárquica das nanoestruturas de peptídeos", sua equipe descobriu que, quando dispersos na água, essas nanoestruturas filamentares podem se organizar em feixes hexagonais. Os pesquisadores ficaram surpresos ao descobrir que em concentrações suficientemente altas na solução, os filamentos podem se auto-montar espontaneamente em estruturas cristalinas (os feixes hexagonais). Ainda mais surpreendente foi a descoberta de que os raios X usados para sondar as nanoestruturas às vezes também desencadeavam a cristalização dos filamentos. Este trabalho pode impactar nossa compreensão das nanoestruturas em sistemas biológicos e nossa capacidade de controlar a estrutura dos materiais.
p Os filamentos usados para esta pesquisa possuíam diâmetros em torno de 10 nanômetros e comprimentos da ordem de dezenas de micrômetros. Os filamentos foram derivados de uma molécula sintética contendo uma sequência curta de peptídeo. Os peptídeos são compostos que contêm dois ou mais aminoácidos. Aqui, a sequência peptídica consistia em seis moléculas de aminoácidos de alanina ligadas a três moléculas de ácido glutâmico - abreviado Ala
6 Glu
3 - que por sua vez foi enxertado em uma molécula de alquila. As “supramoléculas” resultantes se auto-montaram em água para formar os filamentos.
p Uma seqüência de experimentos foi desenhada para revelar a disposição dos filamentos dispersos na água. Diferentes concentrações aquosas dos filamentos foram colocadas dentro de minúsculos capilares de quartzo de 2 mm de diâmetro e estudadas utilizando espalhamento de raios-x de pequeno ângulo (SAXS) na linha de luz DND-CAT. As concentrações variaram de 0,5 a 5 por cento em peso. Os dados SAXS revelaram que todas as concentrações de filamentos agregados em feixes exibindo um empacotamento hexagonal (ver Fig. 1). A organização dos filamentos em feixes hexagonais (isto é, cristalização) é bastante notável. Mas ainda mais notável foi a observação de que a maior concentração de filamentos (2 e 5 por cento em peso) cristalizou espontaneamente, enquanto as soluções de concentração mais baixa (0,5 e 1 por cento em peso) cristalizaram apenas por meio da exposição aos raios-x.
p De acordo com o Prof. Stupp, a cristalização dos filamentos, seja por auto-montagem ou por exposição a raios-x, constituem fenômenos que “não vimos antes” em outros sistemas supramoleculares. Stupp também observou que “ao fazer os experimentos no síncrotron APS, ficamos surpresos ao descobrir que os raios-X podem promover a cristalização. ”
p Uma característica fascinante da cristalização induzida por raios-X foi a reversibilidade do processo, que era realmente visível. Usando a solução de 1 por cento em peso, 200 segundos cumulativos de irradiação de raios-x tornaram a solução inicialmente transparente opaca, indicando cristalização. Após a cessação do raio-x, a opacidade da solução diminuiu lentamente até que ficou clara novamente em cerca de 40 minutos, indicando um retorno à desordem. Um experimento SAXS de acompanhamento expôs a solução a uma série de rajadas de raios-X de 4 segundos. Os dados experimentais mostraram que os filamentos inicialmente desordenados (revelados pela primeira exposição de 4 segundos) gradualmente sofreram uma mudança para feixes de filamentos ordenados hexagonalmente, conforme registrado durante as últimas exposições de raios-x. Quando o experimento foi repetido duas horas depois, os dados do SAXS revelaram que os filamentos estavam novamente desordenados - a estrutura cristalina havia desaparecido.
p Os pesquisadores consideraram se fatores estranhos podem ter contribuído para o pedido dos filamentos. Raios-x intensos podem criar novos compostos químicos dentro de uma solução devido à ionização, além de produzir aquecimento sutil. Contudo, testes subsequentes das soluções filamentares mostraram que nenhuma das espécies químicas indesejadas, nem efeitos térmicos, desempenhou um papel nas cristalizações espontâneas ou desencadeadas por raios-X.
p Com relação ao mecanismo básico responsável pela cristalização, os pesquisadores imaginam que a estabilidade a longo prazo dos domínios cristalinos é um equilíbrio entre duas tensões opostas:cargas elétricas que residem nos filamentos (tanto nativas quanto induzidas por irradiação de raios-X) tendem a separar os feixes de filamentos, enquanto o aprisionamento de filamentos dentro da rede maior leva a uma compressão mecânica interna.
p Os dados experimentais revelaram que, à medida que a concentração do filamento cresceu, o número de filamentos dentro dos feixes também aumentou, até que uma concentração crítica de filamentos resultou em seu arranjo hexagonal espontâneo dentro dos feixes (isto é, cristalização). Por outro lado, concentrações filamentares mais baixas - incapazes de cristalizar espontaneamente - só puderam fazer isso quando os raios-x aumentaram a densidade de carga nas superfícies dos filamentos, alterando assim o equilíbrio das forças inter-filamentosas em favor da cristalização.
p O mesmo mecanismo que criou suas redes filamentosas cristalinas feitas pelo homem pode muito bem funcionar em células biológicas, levando o Prof. Stupp a observar que “esta pesquisa pode nos ajudar a entender a organização das nanoestruturas em sistemas biológicos, e também pode ter aplicações no controle da estrutura dos materiais. ”
