Implementação experimental de holografia de fluorescência de disparo único. Configuração de holografia de cisalhamento de fluorescência obtida pela extensão de um microscópio de campo amplo de fluorescência com um sensor de frente de onda composto por uma grade de fase 0-π 2D e um sistema de imagem de relé montado na porta de saída do microscópio. A abertura dura bloqueia todas as ordens de difração, exceto as primeiras. Crédito:Science Advances, doi:10.1126 / sciadv.abc2508
Biólogos costumam usar microscopia de fluorescência devido à especificidade molecular e super-resolução da técnica. Contudo, o método é restringido por limites de imagem. Em um novo relatório sobre Avanços da Ciência , Matz Liebel e uma equipe de pesquisa do Instituto de Ciência e Tecnologia de Barcelona e do Hospital Geral de Massachusetts na Espanha e nos EUA relataram uma abordagem de imagem para recuperar o campo elétrico completo da luz fluorescente usando a sensibilidade de uma única molécula. A equipe experimentou o conceito de holografia digital para detecção rápida de fluorescência, rastreando a trajetória tridimensional (3-D) de nanopartículas individuais usando uma resolução no plano de 15 nanômetros. Como aplicações biológicas de prova de conceito, os pesquisadores imaginaram o movimento 3-D das vesículas extracelulares dentro das células vivas.
Nano entrega em tecido vivo
Nesse trabalho, Liebel et al. desenvolveram localização de partículas 3-D baseada em holografia de fluorescência através de vesículas extracelulares dentro de células vivas e observaram vesículas fortemente confinadas com períodos de transporte ativo. Entregar o transporte de carga in vivo é atualmente um desafio significativo, a fim de implementar ativamente plataformas de nanomedicina minimamente invasivas. Nanopartículas (NPs) e veículos extracelulares podem ser projetados como candidatos promissores para serem entregues como veículos, mas os cientistas ainda não entendem a jornada precisa de tais dispositivos em tecidos vivos.
Para superar esses desafios, eles devem desenvolver métodos de imagem de partícula única tridimensionais (3-D) de campo amplo para rastrear partículas individuais simultaneamente enquanto viajam para o destino pretendido. As equipes de pesquisa já haviam implementado abordagens holográficas para microscopia, embora a incoerência da luz fluorescente não seja adequada para células vivas ou imagem de molécula única. Em comparação, a interferometria de cisalhamento é um método promissor para realizar o registro de um único disparo de processos dinâmicos. A ideia subjacente por trás da interferometria de cisalhamento inclui autointerferência para acessar gradientes de fase até um nível de fóton único para obter holografia de fluorescência de disparo único. Os mecanismos desenvolvidos neste trabalho, portanto, servem para observar a translocação intracelular em escalas de comprimento de micrômetro para fornecer aos biólogos uma visão mais profunda dos mecanismos intracelulares.

Fluxo de trabalho de reconstrução de campo elétrico. (A) Imagem obtida experimentalmente de esferas fluorescentes de 200 nm fora de foco mostrando a modulação espacial induzida por cisalhamento das funções de espalhamento de ponto (PSFs). (B) A transformação rápida de Fourier (FFT) de (A) permite o isolamento dos termos de interferência de interesse em ambas as dimensões x e y por meio de isolamento de abertura rígida e mudança para frequência zero. (C) A transformação inversa rápida de Fourier (iFFT) dos termos isolados de (B) produz os gradientes de fase desejados. (D) A integração analítica 2D com um solucionador de Poisson produz a imagem de fase bruta. (E) Escala de fase, para contabilizar a distância entre a grade e o chip da câmera, seguido por resultados de correção de aberração nas imagens de fase e amplitude finais. Todas as barras de escala são idênticas, e o encapsulamento de fase 0-2π é apenas para fins de visualização; as informações desembrulhadas são obtidas diretamente. Crédito:Science Advances, doi:10.1126 / sciadv.abc2508
Princípio de geração de imagens e validação do sistema para rastreamento de partículas 3-D
A equipe usou um microscópio de fluorescência de campo amplo com um sensor de cisalhamento de frente de onda composto por um sistema de imagem de relé. A geometria da configuração garantiu que gradientes de fase diferentes de zero foram medidos e permitiu Liebel et al. para realizar a autointerferência de um único fóton em uma imagem inteira. A equipe obteve imagens de grânulos de poliestireno fluorescentes como partículas fora de foco de 200 nm e extraiu a informação de intensidade como módulo de argumento das imagens filtradas para extração de gradiente de fase. Depois de observar todo o campo elétrico, eles usaram a ótica de Fourier para corrigir aberrações induzidas por espalhamento complexo ou construir imagens em qualquer plano de escolha. A equipe se concentrou em experimentos de localização 3-D que exigem a recuperação da posição precisa de um emissor de interesse em todas as dimensões, incluindo o plano Z. Os esforços de focalização computacional indicaram a habilidade precisa de determinar a posição 3-D de múltiplas partículas fluorescentes de difusão livre.
Testando a trajetória de focalização computacional
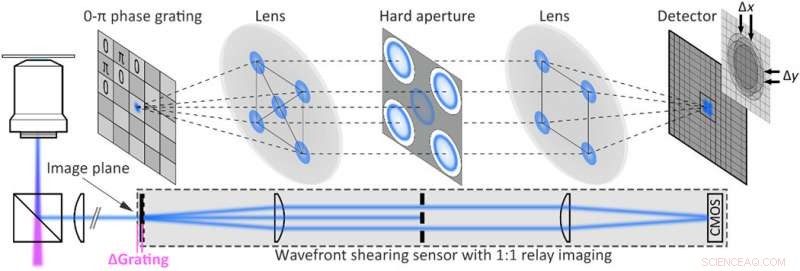
Experimentos de prova de conceito. (A) Uma esfera fluorescente de 200 nm registrada 4,4 μm acima do foco (parte superior) é reorientada computacionalmente (parte inferior). A inserção mostra uma imagem em foco obtida experimentalmente da mesma partícula ao lado de um corte através dos respectivos PSFs (tracejado branco:em foco; rosa, sólido:reorientado). (B) Rastreamento 3D simultâneo de três grânulos fluorescentes de 200 nm movendo a amostra com um estágio piezo ao longo de uma trajetória conhecida (rosa:movimento piezoelétrico; azul:trajetórias reconstruídas de grânulos individuais; preto:trajetória média). As trajetórias individuais são sobrepostas em x / y para maior clareza; z =0 μm corresponde a uma partícula em foco. (C) Trajetórias piezoelétricas limitadas por sub-difração (rosa) em comparação com uma imagem típica obtida 900 nm acima do foco (esquerda). As projeções resultantes da trajetória média de y / z e x / z (preto) concordam bem com a trajetória do piezo (rosa), e os pontos azuis mostram todas as posições obtidas rastreando simultaneamente 17 esferas fluorescentes individuais (direita). A análise baseada em histograma das precisões de localização rendem σx / σy =15 nm e σz =21,5 nm, respectivamente (nota S7). (D) Moléculas ATTO647N únicas registradas fora de foco (esquerda) são focadas computacionalmente (meio) com sucesso. As áreas representativas de emissão de fluorescência (rosa, roxa, e azul) mostram fotodegradação de uma etapa conforme esperado para emissores únicos. (E) Traços de tempo de fotobranqueamento das três regiões destacadas em (D); a linha tracejada indica o nível de fundo. Crédito:Science Advances, doi:10.1126 / sciadv.abc2508
Para testar o raciocínio computacional por trás da configuração, Liebel et al. gerou uma trajetória 3-D conhecida e moveu uma amostra contendo esferas fluorescentes imobilizadas - enquanto registrava imagens ao longo do caminho. Eles recuperaram as informações de fase e amplitude e determinaram as posições 3-D de partículas individuais usando propagação numérica. Para quantificar o intervalo Z acessível, eles desfocaram experimentalmente partículas individuais e, em seguida, refocalizaram computacionalmente as imagens para obter medições livres de artefatos em um intervalo Z de aproximadamente oito µm. É importante garantir a localização precisa em nanoescala em escalas de comprimento de micrômetro em 3-D para difusão de imagens em partículas em nanoescala. A holografia de fluorescência atendeu a esses requisitos. Como prova de conceito, os cientistas imaginaram a palavra "holografia, "onde cada letra individual de entrada mede menos de 50 nm de largura para obter uma saída bem resolvida, confirmando a capacidade de super-resolução da holografia fluorescente.
Imagem de molécula única e a absorção celular de nanopartículas
A equipe mostrou como a holografia de fluorescência funcionava em condições de super-resolução biologicamente importantes, medindo uma amostra composta de moléculas individuais. Apesar das intensidades de fluorescência marcadamente reduzidas na configuração experimental, a equipe obteve foco computacional para o limite de difração, mesmo para níveis de fótons tão baixos quanto 10 4 fótons. Eles visualizaram o tráfego intracelular de nanopartículas inorgânicas e vesículas extracelulares usando o sistema. Como um sistema modelo, eles usaram nanobastões de ouro marcados com fluorescência que são inertes e, portanto, sem interferência com as funções celulares para se acumular no citoplasma, conforme verificado usando imagens de campo escuro de células vivas. A equipe seguiu as trajetórias das partículas gravando imagens de fluorescência com lapso de tempo e extraiu os termos de fase e amplitude. As funções de propagação de ponto amplamente variáveis (PSFs) indicaram a presença de nanobastões em diferentes posições Z em relação ao plano focal.

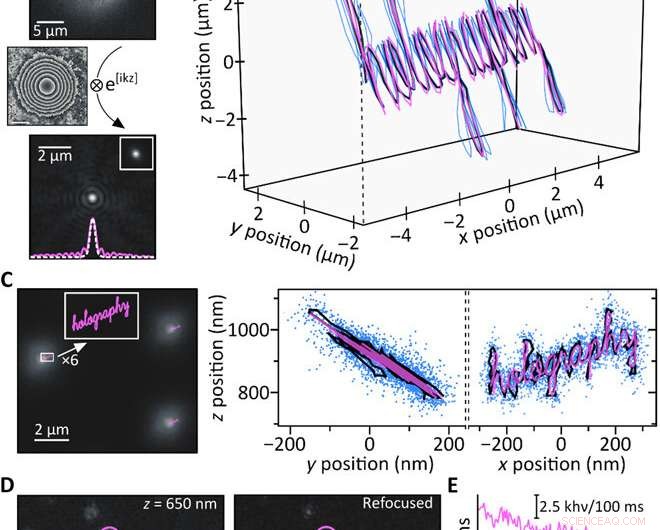
Rastreamento de fluorescência 3D em células vivas. (A) Experiência típica de rastreamento de partícula única de célula viva. (B) Imagens de fluorescência saturada (rosa) sobrepostas em imagens de campo claro correspondentes de células de rim de macaco. (C) Amplitude de fluorescência (esquerda) e fase (direita) obtidas pela amostra de células de imagem B. Todos os filmes são gravados com tempo de exposição de 100 ms em um total de 100 quadros em um ciclo de trabalho de imagem de 1/20 para permitir a longo prazo imagem. Para compensar as grandes diferenças de brilho entre as partículas em foco e fora de foco, exibimos a amplitude normalizada em vez da intensidade de fluorescência e limitamos a escala em 0,5 com o máximo sendo 1. Inserções:original, desembrulhado, imagens de fase destacando a curvatura convexa / côncava das partículas acima / abaixo do plano focal da imagem. (D) Comparações de segmentos de imagem de amplitude original obtidos em (C) com imagens obtidas por propagação computacional de -2 µm (topo) e 2 µm (fundo). (E) Trajetórias 3D obtidas por holografia de fluorescência para difusão de partículas dentro de células vivas. Cada trajetória individual tem uma barra de escala individual, e a posição z é codificada por cores. Crédito:Science Advances, doi:10.1126 / sciadv.abc2508
A equipe realizou a localização 3-D de cada nanobastão individual na célula e reconstruiu as trajetórias das partículas em 100 quadros de observação para obter seis categorias representativas, onde algumas partículas permaneceram imóveis durante os 200 segundos de tempo de observação, enquanto outros se difundiram livremente em vários micrômetros. As partículas restantes mostraram estados ligados e difusos. Desta maneira, o método de holografia de fluorescência subjacente pode determinar com precisão as posições 3-D.
Captação celular e transporte ativo de vesículas extracelulares
Liebel et al. em seguida, estudou o transporte 3-D ativo de vesículas extracelulares (EVs) dentro das células vivas, incubando células HeLa com EVs marcados com fluorescência. Eles adquiriram hologramas fluorescentes a cada quatro segundos para reconstruir trajetórias 3-D de EVs individuais por meio de uma combinação de trajetórias manuais e automatizadas, ligando as posições EV 3-D. Liebel et al. projeções de amplitude de lapso de tempo sobrepostas de hologramas fluorescentes com imagens de campo claro gravadas simultaneamente de células individuais, para mostrar como a maioria dos EVs foram localizados na borda das células aderentes. As observações e cálculos sugeriram que os EVs estavam presos dentro de uma área, limitar seu movimento a um volume específico; provavelmente pertencendo ao citoesqueleto celular.
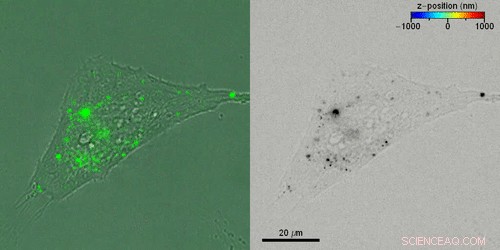
Reconstruindo as trajetórias 3-D de vesículas extracelulares individuais (EVs) dentro das células vivas. Crédito:Science Advances, doi:10.1126 / sciadv.abc2508
Panorama
Desta maneira, Matz Liebel e colegas desenvolveram um grande método de holografia de fluorescência de campo de visão único para permitir o rastreamento de uma única partícula 3-D em um intervalo Z de aproximadamente oito micrômetros. Para provar este conceito, a equipe implementou uma configuração experimental fácil com uma taxa de transferência otimizada de fótons. Os recursos otimizados permitiram que a holografia de fluorescência fosse uma abordagem ideal para estudar o rastreamento de partículas em tempo real. A equipe mostrou rastreamento de partícula única em 3D e observou o movimento de objetos em nanoescala em células vivas, como nanobastões de ouro marcados com fluorescência e EVs (vesículas extracelulares). Enquanto os nanobastões de ouro apenas se agregaram no citoplasma sem internalização no núcleo, os EVs acumulados nas bordas das células aderentes em um efeito de aglomeração. Liebel et al. esperar realizar coloração adicional para identificar o citoesqueleto intracelular, conectando assim a arquitetura intracelular ao movimento das vesículas extracelulares. Esses esforços vão lançar luz sobre os mecanismos precisos de transporte de carga e internalização de partículas dentro das células com aplicações importantes em nanomedicina para responder a questões críticas em biologia e medicina. O mecanismo é igualmente adequado para conduzir outros métodos de imagem volumétricos para rastrear tecidos internos e para imagens bioquímicas de cálcio.
© 2020 Science X Network