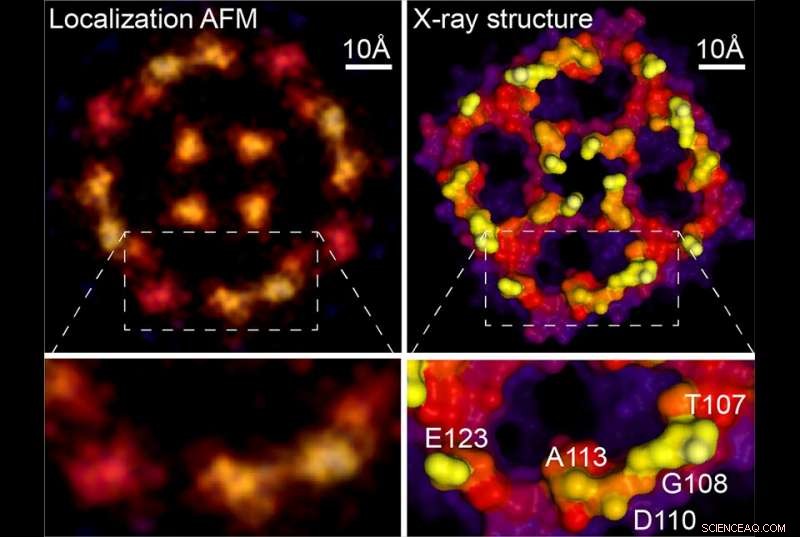
Localização AFM e estrutura de raios-X. Crédito:Weill Cornell Medicine, University of Leeds e Washington University
Cientistas da Weill Cornell Medicine desenvolveram uma técnica computacional que aumenta muito a resolução da microscopia de força atômica, um tipo especializado de microscópio que "sente" os átomos em uma superfície. O método revela detalhes de nível atômico em proteínas e outras estruturas biológicas em condições fisiológicas normais, abrindo uma nova janela na biologia celular, virologia e outros processos microscópicos.
Em um estudo, publicado em 16 de junho em Natureza , os investigadores descrevem a nova técnica, que se baseia em uma estratégia usada para melhorar a resolução em microscopia de luz.
Para estudar proteínas e outras biomoléculas em alta resolução, os investigadores confiam há muito em duas técnicas:cristalografia de raios X e microscopia crioeletrônica. Embora ambos os métodos possam determinar estruturas moleculares até a resolução de átomos individuais, eles fazem isso em moléculas que são estruturadas em cristais ou congeladas em temperaturas ultra-frias, possivelmente alterando-os de suas formas fisiológicas normais. A microscopia de força atômica (AFM) pode analisar moléculas biológicas em condições fisiológicas normais, mas as imagens resultantes ficaram desfocadas e com baixa resolução.
"A microscopia de força atômica pode facilmente resolver átomos na física, em superfícies sólidas de silicatos e semicondutores, então isso significa que, em princípio, a máquina tem a precisão para fazer isso, "disse o autor sênior Dr. Simon Scheuring, professor de fisiologia e biofísica em anestesiologia na Weill Cornell Medicine. "A técnica é um pouco como se você pegasse uma caneta e digitalizasse as Montanhas Rochosas, para que você obtenha um mapa topográfico do objeto. Na realidade, nossa caneta é uma agulha afiada em poucos átomos e os objetos são moléculas de proteína única. "
Contudo, moléculas biológicas têm muitas partes pequenas que se mexem, borrando suas imagens AFM. Para resolver esse problema, Dr. Scheuring e seus colegas adaptaram um conceito da microscopia de luz chamado microscopia de super-resolução. "Teoricamente, não era possível por microscopia óptica resolver duas moléculas fluorescentes que estavam mais próximas do que a metade do comprimento de onda da luz, "disse ele. No entanto, estimulando as moléculas adjacentes a fluorescência em momentos diferentes, microscopistas podem analisar a propagação de cada molécula e localizar suas localizações com alta precisão.
Em vez de estimular a fluorescência, A equipe do Dr. Scheuring observou que as flutuações naturais das moléculas biológicas registradas ao longo das varreduras de AFM produzem propagações semelhantes de dados posicionais. Primeiro autor, Dr. George Heath, que era pós-doutorado na Weill Cornell Medicine no momento do estudo e agora é membro do corpo docente da University of Leeds, engajado em ciclos de experimentos e simulações computacionais para entender o processo de imagem AFM em maiores detalhes e extrair o máximo de informações das interações atômicas entre a ponta e a amostra.
Usando um método como análise de super resolução, eles foram capazes de extrair imagens de resolução muito mais alta das moléculas em movimento. Continuando a analogia topográfica, Dr. Scheuring explicou que "se as rochas (ou seja, átomos) balançam um pouco para cima e para baixo, você pode detectar este, então aquele, e então você calcula a média de todas as detecções ao longo do tempo e recebe informações de alta resolução. "
Como estudos anteriores de AFM coletaram rotineiramente os dados necessários, a nova técnica pode ser aplicada retroativamente às imagens borradas que o campo gerou por décadas. Como um exemplo, o novo artigo inclui uma análise de uma varredura AFM de uma proteína de membrana de aquaporina, adquirido originalmente durante a tese de doutorado do Dr. Scheuring. A reanálise gerou uma imagem muito mais nítida que se assemelha às estruturas de cristalografia de raios-X da molécula. "Você basicamente consegue uma resolução quase atômica nessas superfícies agora, "disse o Dr. Scheuring. Para mostrar o poder do método, os autores fornecem novos dados de alta resolução sobre a anexina, uma proteína envolvida no reparo da membrana celular, e em um antiporter próton-cloreto do qual também relatam mudanças estruturais relacionadas ao seu funcionamento.
Além de permitir aos pesquisadores estudar moléculas biológicas sob condições fisiologicamente relevantes, o novo método tem outras vantagens. Por exemplo, A cristalografia de raios-X e a microscopia crioeletrônica baseiam-se na média de dados de um grande número de moléculas, mas AFM pode gerar imagens de moléculas individuais. "Em vez de ter observações de centenas de moléculas, observamos uma molécula cem vezes e calculamos um mapa de alta resolução, "disse o Dr. Scheuring.
A obtenção de imagens de moléculas individuais durante o desempenho de suas funções pode abrir tipos inteiramente novos de análise. "Digamos que você tenha uma proteína de pico [viral] que está em uma conformação e, em seguida, é ativada e entra em outra conformação, "disse o Dr. Scheuring." Em princípio, você seria capaz de calcular um mapa de alta resolução a partir dessa mesma molécula enquanto ela transita de uma conformação para a outra, não de milhares de moléculas em uma ou outra conformação. "Esses dados de molécula única de alta resolução poderiam fornecer informações mais detalhadas e evitar os resultados potencialmente enganosos que podem ocorrer ao calcular a média de dados de muitas moléculas. Além disso, o mapa pode revelar novas estratégias para redirecionar ou interromper precisamente esses processos.