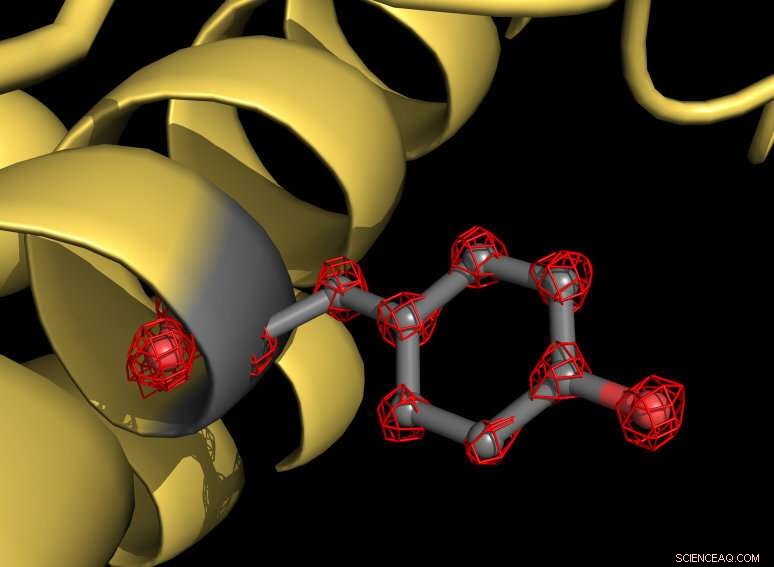
Uma parte da proteína apoferritina (amarela) com uma cadeia lateral de tirosina destacada em cinza. O aminoácido tirosina consiste em vários átomos que são individualmente reconhecíveis na estrutura (estruturas de grade vermelha). Crédito:MPI f. Química Biofísica / Holger Stark
Holger Stark do Instituto Max Planck de Química Biofísica em Göttingen e sua equipe quebraram uma barreira de resolução crucial na microscopia crioeletrônica. Pela primeira vez, seu grupo conseguiu observar átomos individuais em uma estrutura de proteína e obter as imagens mais nítidas de todos os tempos com este método. Essas percepções detalhadas tornam mais fácil entender como as proteínas fazem seu trabalho ou causam doenças na célula viva. A técnica também pode ser usada no futuro para desenvolver novos medicamentos.
Desde a eclosão da pandemia COVID-19, cientistas de todo o mundo têm resolvido estruturas 3-D de proteínas-chave importantes do novo coronavírus. Seu objetivo comum é encontrar locais de encaixe para um composto ativo que pode combater o patógeno de forma eficaz.
Um método aplicado para isso é a microscopia crioeletrônica (crio-EM), que pode ser usado para tornar visíveis as estruturas tridimensionais das biomoléculas. Como são estruturalmente altamente flexíveis, não é uma tarefa fácil. Para capturar as moléculas difusas sem danificá-las, eles são resfriados extremamente rapidamente, ou paralisado pelo choque, por assim dizer. As amostras congeladas são depois bombardeadas com elétrons, e as imagens resultantes são gravadas. Usando estes, a estrutura tridimensional das moléculas pode então ser calculada. Três pioneiros desta técnica, Jacques Dubochet, Joachim Frank, e Richard Henderson, recebeu o Prêmio Nobel de Química pelo desenvolvimento de crio-EM em 2017.
O recorde mundial de resolução permite ver átomos individuais em proteínas
O grupo de Stark agora quebrou a barreira da resolução crio-EM com um microscópio eletrônico criogênico exclusivo desenvolvido recentemente por esta equipe. "Equipamos nosso dispositivo com dois elementos óticos eletrônicos adicionais para melhorar ainda mais a qualidade e a resolução da imagem. Isso garante que os erros de imagem das lentes óticas, as chamadas aberrações, não desempenham mais um papel, "explica o diretor do Max Planck. Seu aluno de doutorado Ka Man Yip acrescenta:" Os microscópios eletrônicos são instrumentos ópticos e fisicamente se parecem com uma câmera. As aberrações de um microscópio eletrônico interferem no crio-EM da mesma forma que as de uma câmera fotográfica. Para uma qualidade de imagem muito melhorada, era crucial evitar esses erros de aberração. "
Usando o novo microscópio, os cientistas fizeram mais de um milhão de imagens da proteína apoferritina para mapear a estrutura molecular com resolução de 1,25 angstroms. Um angstrom é equivalente a um décimo de milionésimo de milímetro. "Agora visualizamos átomos individuais na proteína - um marco em nosso campo, "explica o biólogo estrutural Stark." Para nós, era como colocar super óculos no microscópio. A nova estrutura revela detalhes nunca vistos antes:podemos até ver a densidade dos átomos de hidrogênio e as modificações químicas de um único átomo. "
O grande potencial do crio-EM para geração de imagens de estruturas de proteínas 3-D de alta resolução também foi demonstrado por colegas do Laboratório de Biologia Molecular do Conselho de Pesquisa Médica em Cambridge (Reino Unido). Eles alcançaram uma resolução similarmente alta usando uma abordagem diferente. "Agora é concebível que o crio-EM no futuro seja capaz de alcançar resoluções subatômicas, "diz o pesquisador.
Base para o projeto de medicamentos com base na estrutura
Mas qual é a vantagem de poder estudar uma estrutura de proteína com resolução atômica sem precedentes? Para entender como funciona uma máquina feita pelo homem, é preciso observar seus componentes diretamente no trabalho. Isso também é verdadeiro para as proteínas - as nanomáquinas das células vivas. Para ter uma ideia de como realizam suas tarefas, é preciso saber a posição exata de todos os átomos da proteína.
Essas percepções detalhadas também são relevantes para o projeto de medicamentos com base na estrutura. Os compostos para drogas são personalizados de forma que se liguem às proteínas virais, por exemplo, e bloquear sua função. Mas qual é o mecanismo de inibição subjacente? Os pesquisadores só podem elucidar e entender isso se puderem observar em nível atômico como um composto e uma proteína viral interagem. Essas novas descobertas ajudam a melhorar as moléculas de medicamentos e a reduzir os efeitos colaterais. "Com a quebra dessa barreira de resolução crio-EM, a técnica atingiu um nível onde os benefícios para o desenvolvimento farmacêutico são diretamente visíveis, "diz Stark.