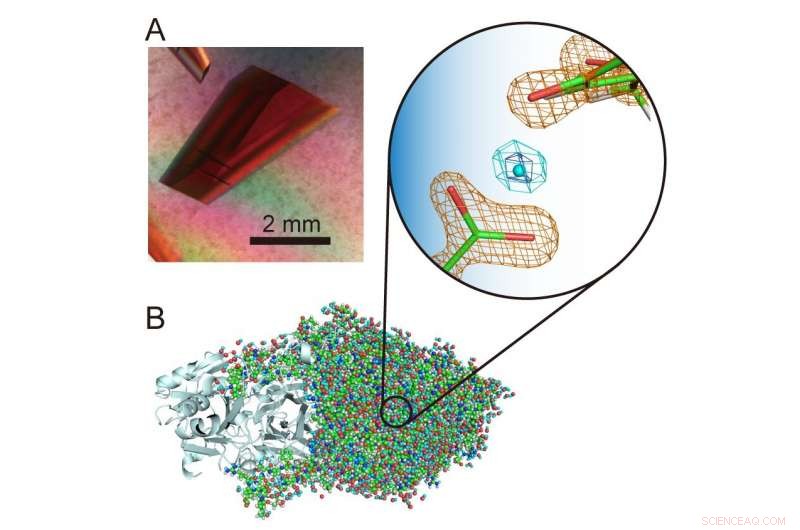
(A) Cristal extragrande de uma oxidase de amina de cobre. (B) Estrutura tridimensional da amina oxidase de cobre incluindo átomos de hidrogênio. Um próton "levitado" incomum é apresentado no centro da visão ampliada. Crédito:Universidade de Osaka
Compreender o comportamento das proteínas e enzimas é a chave para desvendar os segredos dos processos biológicos. As estruturas atômicas das proteínas são geralmente investigadas usando cristalografia de raios-X; Contudo, a informação precisa para átomos de hidrogênio e prótons (íons de hidrogênio) é geralmente inatingível. Agora uma equipe que inclui a Universidade de Osaka, Osaka Medical College, Institutos Nacionais de Ciência e Tecnologia Quântica e Radiológica, Universidade Ibaraki, e a Universidade de Tsukuba usou a cristalografia de nêutrons para revelar detalhes estruturais de alta resolução de uma proteína oxidase muito grande. Suas descobertas são publicadas em PNAS .
Os átomos de hidrogênio e prótons que constituem cerca de metade dos átomos em proteínas e enzimas frequentemente desempenham papéis cruciais nas funções que essas biomoléculas executam; Contudo, suas posições exatas são difíceis de identificar devido ao seu tamanho pequeno. A abordagem mais comum para trabalhar a estrutura de uma proteína é direcionar um feixe de raios-X de alta energia em um cristal de proteína e analisar o padrão de difração que resulta das interações dos raios-X com os elétrons dos átomos no estrutura. Infelizmente, Os raios X não interagem fortemente com átomos de hidrogênio ou prótons, que têm baixa ou nenhuma densidade de elétrons, tornando-os difíceis de "ver".
Uma solução é aplicar um feixe de nêutrons ao cristal em vez de raios-X. Os nêutrons interagem com os núcleos dos átomos em seu caminho, incluindo aqueles de átomos de hidrogênio e prótons, apesar de serem pequenos. Os padrões de difração resultantes dessas interações são registrados após o feixe de nêutrons passar pelo cristal, e são decodificados nas localizações precisas dos núcleos, incluindo os núcleos de hidrogênio.
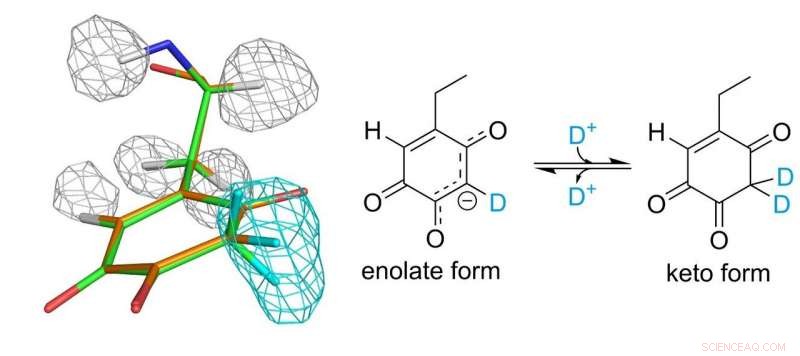
Estrutura do cofator topa quinona. Malhas cinza e azul claro representam densidades de átomos de hidrogênio e deutério, respectivamente. Crédito:Universidade de Osaka
"Os átomos de hidrogênio e prótons são componentes particularmente interessantes das estruturas enzimáticas porque podem exibir comportamentos quânticos que recentemente foram considerados cruciais para a função enzimática. Portanto, é importante determinar com precisão suas localizações na estrutura da proteína para desvendar o que está acontecendo , "O autor correspondente do estudo, Toshihide Okajima, explica." Usando a cristalografia de nêutrons, fomos capazes de determinar a estrutura de uma amina oxidase de cobre bacteriana com um peso molecular de 70, 600 - que é extremamente grande para a cristalografia de nêutrons e excede significativamente as massas moleculares registradas anteriormente - e ainda localiza com precisão os átomos de hidrogênio e prótons na estrutura. Um próton "levitado" incomum foi observado entre um co-fator, topa quinona, e um resíduo de aminoácido estritamente conservado nesta classe de enzimas. "
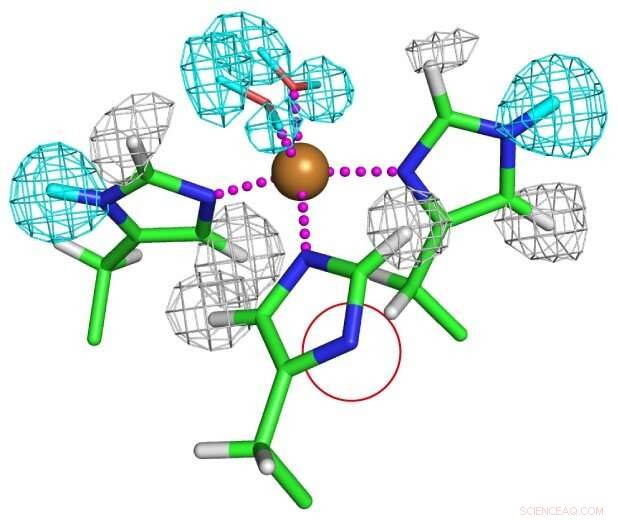
Estado de protonação de resíduos de histidina coordenados com cobre. Um dos resíduos de histidina está totalmente desprotonado como mostrado em um círculo vermelho para formar um ânion imidazolato incomum. Crédito:Universidade de Osaka
O cofator topquinona ligado covalentemente à enzima desempenha um papel essencial na função catalítica. Os pesquisadores finalmente conseguiram estabelecer um quadro completo da topquinona 30 anos após sua descoberta como um cofator derivado de proteína. Eles descobriram que o cofator realmente existe em equilíbrio entre duas formas diferentes.
"Os locais ativos da enzima - onde as reações ocorrem - podem nos fornecer uma grande quantidade de informações e inspiração se formos capazes de compreender totalmente o que está acontecendo, "Okajima explica." Nossa demonstração do uso da cristalografia de nêutrons para descobrir os efeitos quânticos do próton promete ser muito útil para muitos pesquisadores que estudam enzimas e seus mecanismos. "