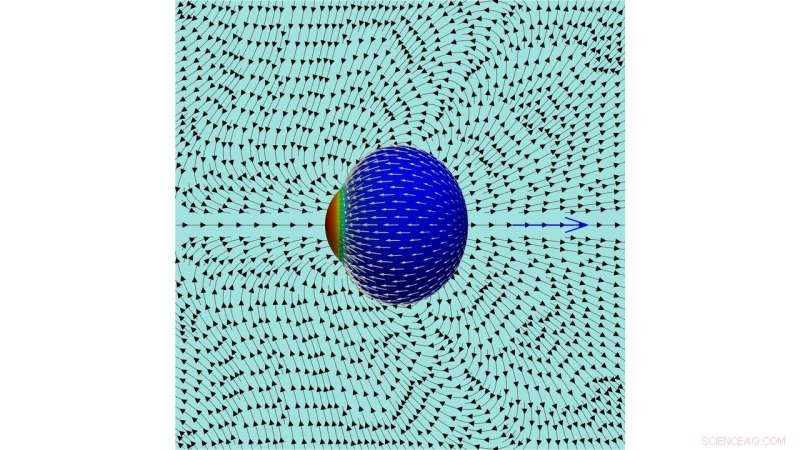
Uma imagem das linhas de fluxo no fluido externo criado por uma célula em movimento. Crédito:Farutin et al.
Motilidade celular, o movimento espontâneo de células de um local para outro, desempenha um papel fundamental em muitos processos biológicos, incluindo respostas imunes e metástases. Estudos de física recentes reuniram novas evidências sugerindo que as células de mamíferos não se arrastam apenas em substratos sólidos, incluindo meios complexos 3-D de tecidos, mas também pode nadar em fluidos.
Em um estudo recente, uma equipe de pesquisadores da Universidade Grenoble Alpes e do CNRS (Centro Nacional de Pesquisa Científica) tentou lançar luz sobre os mecanismos por trás do aparecimento de células de motilidade em suspensão, que ocorreria se eles estivessem se movendo em fluidos. Seu papel, publicado em Cartas de revisão física , apresenta um modelo que acopla a cinética de actina e miosina com fluxo de fluido, que eles aplicaram a uma forma esférica e não esférica.
"Estudos recentes sugeriram que a adesão não é necessária para as células se moverem em um ambiente tridimensional, e até mostraram que as células do sistema imunológico podem nadar quando suspensas em um fluido, "os pesquisadores que conduziram o estudo disseram ao Phys.org por e-mail.
O movimento de uma célula através de um tecido pode ser, pelo menos até certo ponto, em comparação com seu movimento natatório em um gel composto de filamentos de colágeno e fluido intersticial. Este movimento de natação em particular, Contudo, torna as células um tanto autônomas de um substrato, permitindo-lhes navegar por qualquer órgão sem ter que se adaptar a ligantes extracelulares alternados, o que seria necessário ao rastejar em um substrato sólido.
A equipe da Universidade de Grenoble Alpes queria mostrar que as células podem nadar em um fluido usando os mesmos mecanismos ou mecanismos muito semelhantes que usam quando rastejam em um sólido. Além disso, eles desejavam investigar a origem dessa motilidade e descobrir o feedback fornecido pelo meio externo aos processos celulares internos.
"Embora tenhamos colaborado de perto com vários experimentalistas para construir nossa visão sobre o problema e coletado ordens de magnitude relevantes das quantidades físicas que manipulamos, nossa abordagem foi principalmente teórica para este artigo, e motivado pela observação de que as células devem navegar de forma eficiente, em vez de serem vinculadas a um substrato (ou seja, rastejando), "disseram os pesquisadores.
O citoplasma das células contém proteínas chamadas actinas e miosinas. Antes de uma célula realmente começar a se mover de um local para outro, moléculas de actina se auto-montam em uma rede ao longo da membrana celular, conhecido como "córtex".
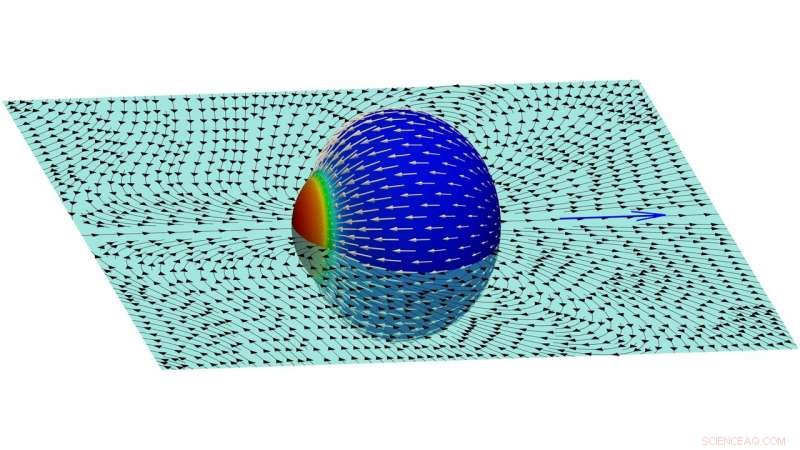
Uma imagem das linhas de fluxo no fluido externo criado por uma célula em movimento. Crédito:Farutin et al.
O modelo de célula idealizado pelos pesquisadores tem dois componentes principais:um gel de córtex de actina e motores de miosina. Os motores de miosina contraem o gel de actina, em última análise, criando um fluxo de proteínas de actina e miosina para áreas com alta concentração de miosina. Eventualmente, isso resulta em toda a miosina concentrada em um único ponto, com a actina fluindo em sua direção.
"Esse fluxo continua perpetuamente, porque novas moléculas de actina são adicionadas na extremidade oposta da célula, "explicaram os pesquisadores." Mostramos que a célula adquire uma polaridade espontânea (ou seja, moléculas de actina são adicionadas em um pólo e removidas na outra extremidade, de forma sustentável). O fluxo de actina ao longo da membrana agarra o fluido externo para alcançar a propulsão celular e produz um padrão de fluxo complexo no fluido circundante. "
Os pesquisadores observaram que, neste cenário, a velocidade de natação de uma célula se assemelha à velocidade que se esperaria ver se ela estivesse rastejando sobre um substrato. Isso é um tanto surpreendente, pois caminhar é normalmente mais fácil do que nadar para os organismos vivos. De acordo com os pesquisadores, isso poderia ser explicado pelo fato de que toda a superfície da célula de natação participa conjuntamente da propulsão.
"Dependendo da renovação e contratilidade do córtex celular (duas propriedades ativas que podem ser controladas pela célula geneticamente ou por meio de vias biológicas específicas), descobrimos que uma célula pode polarizar espontaneamente e começar a se mover em um fluido, "Os pesquisadores disseram." Também é possível obter um comportamento oscilatório onde a célula muda periodicamente de direção. "
O estudo oferece uma visão nova e fascinante sobre os mecanismos por trás da mobilidade de natação das células, ou, como os pesquisadores colocaram, sua capacidade de rastejar em um fluido. Suas observações podem ser particularmente úteis para biólogos que estão tentando entender o movimento das células, pois implicam que uma célula individual pode se mover de forma robusta tanto em um fluido quanto ao longo de um substrato sólido, utilizando os mesmos mecanismos.
Sabe-se agora que as células imunes e as células metastáticas são confrontadas com ambientes muito diferentes à medida que migram dentro de um organismo, ainda assim, os pesquisadores descobriram que os mecanismos que usam para navegar por esses ambientes diferentes podem ser muito semelhantes. Interessantemente, as descobertas reunidas neste trabalho também sugerem que a velocidade de uma célula é definida principalmente pela viscosidade cortical, enquanto a viscosidade do fluido externo não é relevante.
"Com colaboradores que realizam experimentos de células em migração suspensas, pretendemos descobrir como as células podem explorar os mecanismos que descrevemos, "disseram os pesquisadores." Também queremos lançar mais luz sobre os detalhes moleculares de como o fluxo do córtex gera forças de cisalhamento no meio externo, além da membrana celular. Do lado teórico, acreditamos que este modelo ainda tem muitas variantes possíveis que podem render fenômenos interessantes que seriam relevantes para uma gama de dinâmica da actomiosina observada em organismos vivos. "
© 2019 Science X Network