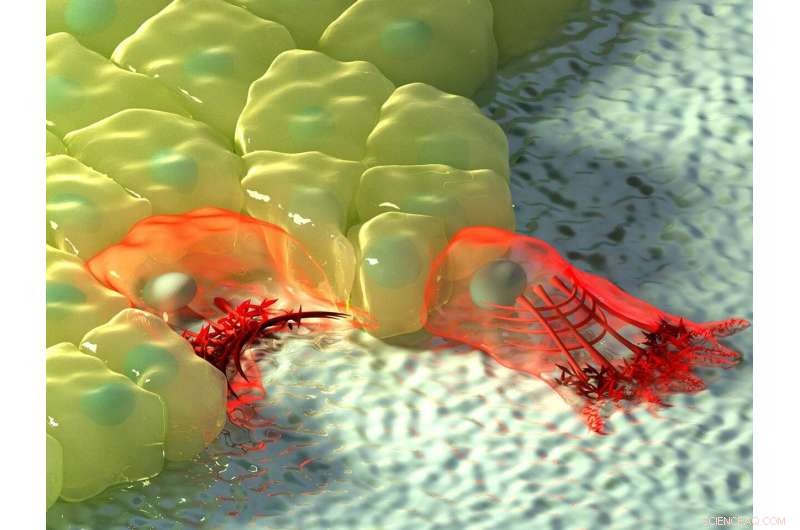
A figura acima mostra uma ilustração artística de células em regiões de curvatura negativa (esquerda) e positiva (direita). Na curvatura negativa, o fluxo de actina se move em direção ao cabo de actina na borda da célula, representado pelo aumento na intensidade da cor, e o cabo contrátil levanta a borda acima do substrato. Na curvatura positiva, lamelipódios se estendem da célula para rastejar ao longo do substrato, e essas saliências são caracterizadas por fluxo retrógrado de actina em direção ao interior da célula. Crédito:Instituto de Mecanobiologia, Universidade Nacional de Singapura
Quando confrontado com terreno difícil, os veículos todo-o-terreno podem mudar da tração nas duas para as quatro rodas para continuar a avançar. De forma similar, a migração celular pode ser conduzida por rastreamento dirigido por protrusão, ou por forças de tração contráteis, mas como a célula alterna entre esses dois métodos permanece um mistério. Um estudo colaborativo liderado pelo aluno de doutorado do MBI Tianchi Chen e o professor Benoit Ladoux do Instituto de Mecanobiologia (MBI) da Universidade Nacional de Cingapura, descobriu que a direção em que os filamentos de actina fluem dentro da célula permite que ela sinta a curvatura física de seus arredores, e esse fluxo direcional é o interruptor de chave que determina qual método de migração é selecionado. O trabalho foi publicado na edição de abril de 2019 da Física da Natureza .
Reorganização induzida por curvatura do fluxo de actina
A migração celular é um processo biológico essencial que impulsiona a formação de tecidos e órgãos durante o desenvolvimento do embrião, e também ajuda a proteger o corpo por meio de resposta imunológica e mecanismos de cicatrização de feridas. As mudanças de forma necessárias para a migração celular dependem da organização dinâmica e geração de força do citoesqueleto de actomiosina interno da célula, que é composta por filamentos estruturais de actina e proteínas motoras da miosina contrátil.
A reorganização desses componentes permite dois mecanismos de migração celular:o crescimento e a extensão das saliências lamelipoidais à base de actina que permitem que a célula "rasteje" para fora, ou a formação de grandes cabos de actomiosina contráteis que podem puxar a célula para frente enquanto geram forças de tração no substrato. Contudo, o processo pelo qual a célula escolhe formar saliências ou cabos contráteis permanece obscuro.
Dependendo da topografia do ambiente físico, as células podem encontrar regiões de curvatura positiva ou negativa. Curvatura positiva se refere a uma forma convexa que se curva para fora, muito parecido com uma letra maiúscula 'D', enquanto um exemplo da curvatura negativa oposta pode ser visto na letra 'C', que forma uma forma côncava que se curva para dentro. Ao observar a migração de células epiteliais em padrões de substrato em forma de flor que são usados para ensaios de fechamento de feridas, um internacional, equipe de pesquisa multidisciplinar liderada pelo Prof Ladoux em colaboração com o Professor Associado Boon Chuan Low da MBI Investigators Principal e o Professor Associado Yusuke Toyama, junto com físicos teóricos e colegas de pesquisa na França, Chile, Israel e Espanha descobriram que em regiões de curvatura positiva, células desenvolveram lamelipódios para rastreamento celular, e em regiões de curvatura negativa, cabos de actina fortes montados que seguiram a borda côncava.
A observação posterior da dinâmica da actina em tempo real usando microscopia de células vivas revelou uma diferença na direção do fluxo de actina nas duas curvaturas. Em lamelipódios induzidos por curvatura positiva, o fluxo de actina era retrógrado, isto é, longe da membrana celular na direção oposta à saliência. Por outro lado, em curvaturas negativas, o fluxo de actina era anterógrado, isto é, em direção à membrana celular onde o cabo de actina estava localizado.
Este fluxo anterógrado conduz a montagem de diferentes, estruturas de actina polarizadas nessas regiões de curvatura negativa. O cabo de actina na borda côncava está localizado na frente, seguido por fibras transversais de actina que são orientadas na mesma direção que o cabo de actina, e na parte traseira da rede estão as fibras radiais de actina orientadas a 90 graus em relação ao cabo de actina. Interessantemente, a formação dessas estruturas de actina polarizadas em resposta à curvatura negativa foi observada em células individuais e camadas de células migrando em uma superfície 2-D, e em células embutidas em redes fibrosas 3-D. Embora esses resultados tenham confirmado a existência de dois mecanismos de migração celular, ainda havia uma questão em aberto sobre como as células eram capazes de sentir a curvatura do ambiente.
Felizmente, a imagem de células vivas forneceu aos pesquisadores uma pista potencial - a mudança na direção do fluxo de actina dependendo da curvatura poderia ser o 'sensor' para mudar o modo de migração. Isso foi confirmado pelo plaqueamento das células epiteliais em uma superfície micro-padronizada revestida com um substrato adesivo, que foi pontilhada com remendos circulares não aderentes. Quando a planilha de células encontrou um círculo não aderente, protrusões lamelipodiais rastejam ao redor do círculo, puxando as células para frente no substrato adesivo. Isso criou automaticamente uma forma côncava em todo o círculo não aderente, que causou uma rápida mudança na direção do fluxo de actomiosina de retrógrado para anterógrado, resultando na montagem de um cabo de actina e um interruptor no mecanismo de migração. O cabo contrátil pode levantar a borda da célula sobre o círculo não aderente, permitindo que a migração da planilha de células continue.
Embora as células contenham sensores de curvatura em sua membrana, como proteínas BAR, estes apenas permitem a detecção de curvatura a nível molecular. Essencialmente, o tamanho dessas proteínas sensoras significa que elas só podem sentir a curvatura em sua vizinhança imediata em uma escala de nanômetros, não ao nível da célula inteira. Contudo, este estudo revela como as células podem sentir mudanças de curvatura de tamanho de célula maiores em uma escala de até dezenas de micrômetros, através da adaptação dinâmica do fluxo de actina.
Esta capacidade permite que a célula selecione um mecanismo apropriado para continuar a migração, mesmo quando confrontado com diversas mudanças no ambiente físico, muito parecido com o modo como um veículo off-road pode alternar entre a tração nas duas e quatro rodas, dependendo do terreno. Com o novo conhecimento deste interruptor de fluxo de actina, os cientistas podem entender melhor como as células podem continuar a migração durante a cicatrização de feridas, ou em situações onde a migração pode ser prejudicial, como a progressão metastática do câncer.