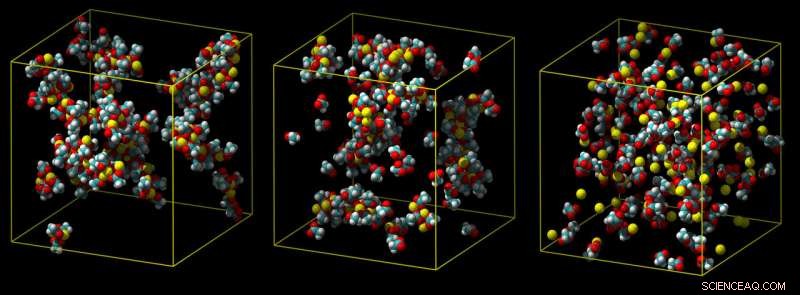
Um modelo de cálcio padrão superestima o quão fortemente o cálcio se liga, levando a grupos de pares de íons (à esquerda). Um modelo intermediário mostra menos aglomeração (meio), e um modelo de escala de carga refinado prevê corretamente uma associação fraca com grupos carboxílicos em água (não mostrado) (direita). Crédito:Philip Mason e Elise Duboue-Dijon
O cálcio é essencial para o funcionamento de nosso corpo. Os íons de cálcio permitem que as células se comuniquem umas com as outras, permitindo que os neurônios interajam, músculos para contrair, e as células musculares do coração para sincronizar e bater. Para entender melhor esses processos, em que os íons de cálcio interagem com moléculas biológicas, como proteínas, os pesquisadores costumam usar simulações de computador. Mas modelos precisos são desafiadores e caros do ponto de vista computacional.
"Se você tiver o modelo errado de cálcio, simplesmente não funcionará, "disse Pavel Jungwirth do Instituto de Química Orgânica e Bioquímica da Academia Tcheca de Ciências em Praga." A maioria dos modelos disponíveis não são precisos o suficiente para capturar as características importantes do íon cálcio. "
Na edição desta semana de The Journal of Chemical Physics , Contudo, O grupo de pesquisa de Jungwirth demonstra como uma modificação direta em um modelo de computador leva a simulações altamente precisas, que servem como ferramentas poderosas para estudar uma variedade de processos biológicos. "Acredito que temos o melhor dos modelos simples de cálcio do mundo no momento, "Disse Jungwirth.
Os íons de cálcio viajam de célula em célula como mensageiros. Quando eles alcançam uma célula, eles se ligam a uma molécula, como uma proteína, desencadeando uma cascata de respostas químicas. Mas, devido ao ambiente aquoso do íon, simular exatamente como o cálcio se liga é difícil.
O íon cálcio, que é duplamente carregado positivamente, interage fortemente com os oxigênios das moléculas de água circundantes. Esses oxigênios têm carga parcial negativa (como na molécula de água) e o átomo de oxigênio atrai os elétrons das ligações com mais eficácia. As forças eletrostáticas entre o cálcio e a água induzem as moléculas de água a se reorganizarem em torno do íon. O íon de cálcio também força os elétrons na molécula de água a se deslocarem, um fenômeno chamado polarização eletrônica.
A maioria das simulações incorpora o rearranjo das moléculas de água. Mas porque calcular exatamente como os elétrons se movem requer muito poder de computação, eles não levam em consideração a polarização eletrônica. Sem polarização eletrônica, Jungwirth disse, simulações envolvendo cálcio são imprecisas.
Tipicamente, interações com moléculas de água funcionam para puxar um íon de cálcio para longe da molécula com a qual ele está tentando se ligar, como em um cabo de guerra molecular. Se uma simulação não levar totalmente esses efeitos em consideração, superestima o quão fortemente o cálcio se liga, produzindo íons que não podem se desvincular, o que é irreal.
Alguns anos atrás, Contudo, Alexei Stuchebrukhov e Igor Leontyev propuseram uma solução:diminuir a carga elétrica dos íons nas simulações. Acontece que escalar a carga por um fator de cerca de 0,75 imita o efeito da polarização eletrônica. Esse dimensionamento simples também não adiciona nenhuma carga computacional extra.
"É quase um milagre, "Jungwirth disse." Sabemos que não é uma solução perfeita, mas talvez resolva 90 por cento do problema. "
Anteriormente, A equipe de Jungwirth testou a estratégia modelando a interação relativamente simples entre os íons cálcio e cloreto. Para verificar se as simulações eram precisas - e se a escala funcionava - eles explodiram soluções reais de cloreto de cálcio com nêutrons. Ao medir como esses nêutrons se espalharam no cloreto de cálcio aquoso, os pesquisadores deduziram sua estrutura e compararam os dados com as simulações.
No novo estudo, os pesquisadores testaram seu modelo com grupos carboxílicos - grupos moleculares encontrados em proteínas, e, portanto, mais relevante para a biologia. Depois de também ajustar a carga do grupo carboxílico, eles mostraram novamente que suas simulações combinavam muito bem com os dados de experimentos de espalhamento de nêutrons.
Como os grupos carboxílicos são simples em comparação com, dizer, uma proteína inteira, os pesquisadores também puderam descrever as interações do cálcio usando cálculos de estrutura eletrônica precisos, mas caros do ponto de vista computacional. Ao comparar esses cálculos com as simulações, eles novamente confirmaram a precisão de seus modelos.
Esses testes mostram que o novo modelo pode simular interações de cálcio com quase qualquer proteína, Jungwirth disse. Os pesquisadores também desenvolveram um modelo análogo que funciona para as interações do cálcio com os fosfolipídios na membrana celular. O próximo passo, ele disse, é fazer o mesmo com as moléculas de DNA e RNA. E mais adiante, os pesquisadores planejam desenvolver um modelo semelhante para o magnésio, outro íon de sinalização importante com seus próprios desafios únicos.